题目内容
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g?cm-3,溶质的质量分数为w,其中含NH3的物质的量为b mol.下列叙述中正确的是( )
分析:A、氨水溶液溶质为氨气,该溶液的密度为ρ g?cm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,根据溶质的质量分数定义计算.
B、根据n=
计算a g NH3的物质的量,溶液体积为VmL,再根据c=
计算溶液的物质的量浓度.
C、氨水的浓度为
=
mol/L,一水合氨是弱电解质.
D、水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,据此判断.
B、根据n=
| m |
| M |
| n |
| V |
C、氨水的浓度为
| bmol |
| V×10-3L |
| 1000b |
| V |
D、水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,据此判断.
解答:解:A、氨水溶液溶质为氨气,该溶液的密度为ρ g?cm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数为
×100%,故A错误;
B、a g NH3的物质的量为
=
mol,溶液体积为VmL,所以溶液的物质的量浓度为
=
mol/L,故B正确;
C、氨水的浓度为
=
mol/L,一水合氨是弱电解质,不能完全电离,所以溶液中溶液中c(OH-)<
mol/L,故C错误;
D、水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,故D错误.
故选:B.
| ag |
| ρVg |
B、a g NH3的物质的量为
| ag |
| 17g/mol |
| a |
| 17 |
| ||
| V×10-3L |
| 1000a |
| 17V |
C、氨水的浓度为
| bmol |
| V×10-3L |
| 1000b |
| V |
| 1000b |
| V |
D、水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,故D错误.
故选:B.
点评:考查物质的量浓度、质量分数的计算与相互关系等,难度中等,理解概念是解题的关键.

练习册系列答案
相关题目
在t℃时,将a g NH3完全溶于水,得到V mL溶液,设该溶液的密度为ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为b mol。下列叙述中不正确的是
A.溶质的质量分数为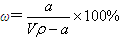 |
B.溶质的物质的量浓度 |
C.溶液中c(OH-)= |
| D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω |