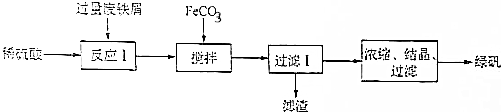
题目内容
14.在某密闭容器中发生可逆反应:2A(g)+B(?)?2C(g)△H;不同温度条件下C的质量分数(c%)符合图1所示的关系.下列说法正确的是( )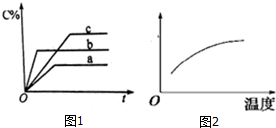
| A. | 正反应吸热,且B一定为气态 | |
| B. | 混合气体的平均摩尔质量随温度变化如图2所示 | |
| C. | 平衡后保持恒容,充入稀有气体,A的转化率增大 | |
| D. | 平衡后保持恒压,充入稀有气体,C的百分含量减小 |
分析 根据先拐先平衡,反应速率快,所以由图1所示,温度b>a>c,则根据b>a,说明温度高C的质量分数(c%)增大,则升温平衡向正反应方向移动,所以正反应吸热反应,但a>c,当温度由c升高到a时,平衡仍然向正反应方向移动,但C的质量分数(c%)反而减小,说明在温度c时B由气态变成非气态,导致总质量减小使C的质量分数(c%)反而减小,据此分析.
解答 解:根据先拐先平衡,反应速率快,所以由图1所示,温度b>a>c,则根据b>a,说明温度高C的质量分数(c%)增大,则升温平衡向正反应方向移动,所以正反应吸热反应,但a>c,当温度由c升高到a时,平衡仍然向正反应方向移动,但C的质量分数(c%)反而减小,说明在温度c时B由气态变成非气态,导致总质量减小使C的质量分数(c%)反而减小,
A、根据以上分析,正反应吸热,且B不一定为气态,故A错误;
B、正反应吸热,则升温平衡向正反应方向移动,所以混合气体的平均摩尔质量随温度升高而增大,故B正确;
C、平衡后保持恒容,充入稀有气体,反应体系压强不变,则平衡不移动,所以A的转化率不变,故C错误;
D、平衡后保持恒压,充入稀有气体,体积增大,相对于减小反应体系的压强,所以平衡向气体体积增大的方向即逆反应方向移动,所以C的百分含量减小,故D正确;
故选:BD.
点评 本题旨在考查学生对化学平衡图象的理解,难度中等,注意采取控制变量法与“先拐先平数值大”原则分析解答.

练习册系列答案
相关题目
9.由CO2、CO和H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、CO和H2的体积比为( )
| A. | 29:13:8 | B. | 13:29:8 | C. | 22:14:1 | D. | 26:57:15 |
19.等物质的量的下列化合物在相应条件下完全分解后,得到O2的质量最多的是( )
| A. | KClO3(加MnO2催化剂,加热) | B. | KMnO4(加热) | ||
| C. | H2O2(水溶液,加MnO2催化剂) | D. | HgO(加热) |
6.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
3.可用于判断化学反应的自发与否的是( )
| A. | 仅用焓变 | B. | 仅用熵变 | C. | 仅用温度差 | D. | 用△H-T△S |
4.下列关于钠的叙述中正确的是( )
| A. | 将钠放在石棉网上加热,钠剧烈燃烧,产生黄色火焰,生成过氧化钠 | |
| B. | 钠的熔点很高 | |
| C. | 钠是银白色金属,硬度很大 | |
| D. | 将钠投入硫酸铜溶液中,有气体产生,同时有红色的铜析出 |