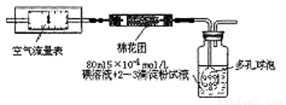
题目内容
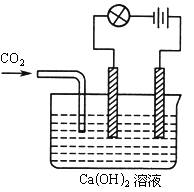
利用下图的装置来做下面的实验:(1)先在玻璃容器里盛半杯Ca(OH )2溶液,然后由导管向容器溶液里通入CO2气体。随着CO2的通入,电灯就渐渐变暗,通入一定量时,电灯几乎完全熄灭,原因是________,如果继续通入CO2气体,电灯又会逐渐亮起来,原因是________。在通入CO2的同时,能观察到溶液发生的现象是________,有关反应的离子方程式为________。
(2)如果用氯化氢气体代替CO2气体,则观察到的现象是________。原因是________。
答案:
解析:
解析:
| (1)Ca2+,OH-离子与CO2发生反应至消耗完全;CaCO3沉淀与CO2,H2O反应,
又生成Ca2+离子、HCO3-离子;溶液先变浑浊,后又变澄清;Ca2++2OH-+CO2=CaCO3↓+H2O, CaCO3+H2O+CO2=Ca2++2HCO3- (2)先灯泡亮度不变,后逐渐变亮,然后保持不变。先是HCl溶于水与Ca(OH)2反应,但溶液中离子浓度不变,当Ca(OH)2反应完全后,继续通入HCl,HCl溶于水,使溶液中浓度增大,最后溶液达到饱和,HCl不再溶液,离子浓度不再改变。 溶液的导电性决定于离子浓度和离子电荷。
|

练习册系列答案
相关题目
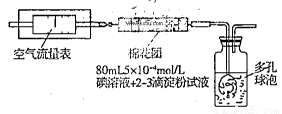
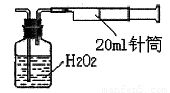
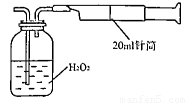 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。