题目内容
某温度下的22%的NaNO3溶液 150mL,加100g水稀释后变为14%.求原溶液中溶质的物质的量浓度.
【答案】分析:根据溶液质量分数的变化,首先计算溶液的质量,进而计算溶质的物质的量,结合原溶液的体积计算物质的量浓度.
解答:解:设原溶液质量为m,则
22%×m=14%×(m+100)g
m=175g
n(NaNO3)=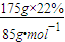 =0.45 mol
=0.45 mol
c(NaNO3)=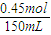 =3.0mol?L-1.
=3.0mol?L-1.
答:原溶液中溶质的物质的量浓度为3.0mol?L-1.
点评:本题考查物质的量浓度的计算,题目难度不大,注意计算溶液的质量为解答该题的关键.
解答:解:设原溶液质量为m,则
22%×m=14%×(m+100)g
m=175g
n(NaNO3)=
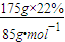 =0.45 mol
=0.45 molc(NaNO3)=
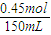 =3.0mol?L-1.
=3.0mol?L-1.答:原溶液中溶质的物质的量浓度为3.0mol?L-1.
点评:本题考查物质的量浓度的计算,题目难度不大,注意计算溶液的质量为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
Ⅰ.实验室称取0.867 g草酸钠(Na2C2O4,式量为134),溶解于水,加入一定量硫酸,用未知浓度的KMnO4溶液滴定,用去KMnO4溶液22.50 mL,反应式如下(未配平):
MnO4- + C2O42- + H+ → Mn2+ + CO2 + H2O。
则装KMnO4的滴定管是_______(填“酸式”或“碱式”); KMnO4溶液的浓度是________mol/L。
Ⅱ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)![]() N(g)+H2(g)
N(g)+H2(g)
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
①该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
②结合表中数据,判断下列说法中正确的是 。
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的量之比为1:4时,M的转化率为0.85
③该温度下,向容器中充入2molM、2mol H2O ,当达平衡时放出a KJ热量,则该反应的
△H=
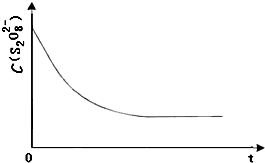 碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.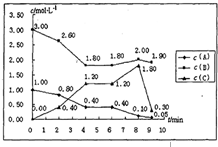 在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示:
在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示: