��Ŀ����
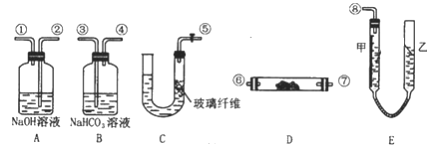
����Ŀ�����������ƣ�Na2S2O5����һ��ʳƷ���Ӽ���ʵ��������ͼ1��ʾװ���Ʊ�Na2S2O5 �� ʵ�鲽�����£�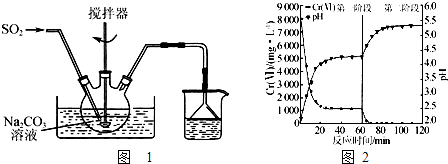
����Na2CO3��Һ��ͨ��SO2��pHΪ4.1������NaHSO3��Һ��
��.��̼���Ʒ�ĩ����pHΪ7��8��
��.��ͨSO2��pHΪ4.1��
��.�ӹ�������Һ������Na2S2O5���壮
��1���Ʊ������������ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
��2��Na2S2O5����ˮ����ˮ�ܷ�Ӧ��������Һ�����ԣ���ԭ���� �� ������вⶨ��Һ��pH�ķ�������pH��4.1ʱ�����Ʒ�л��и�����仯ѧʽ�� ��
��3�����õ������ɲⶨNa2S2O5��Ʒ��+4����ĺ�����ʵ�鷽��Ϊ����һ������Na2S2O5��Ʒ�������ƿ����ĥ��������ƿ���У� �� �ظ����ϲ���2�Σ���¼���ݣ���ʵ���б���ʹ�õ��Լ��У�c1molL��1�ı�����Һ��c2molL��1�ı�Na2S2O3��Һ�������ᡢ������Һ������ˮ����֪��2Na2S2O3+I2�TNa2S4O6+2NaI��
��4��������ˮ�г��������۸�[Cr������]������Na2S2O5��FeSO47H2O�Ⱥ�������δ�����Cr2O72���ķ�ˮ��ʵ��������ͼ��
��ʵ���������Һ��pH�������ߵ�ԭ���� ��
����֪��Ksp[Cr��OH��3]=6.4��10��31 �� lg2��0.3��c��Cr3+����1.0��10��5 molL��1ʱ��Ϊ��ȫ�������ֽ���ˮ��Cr2O72��ȫ��ת��ΪCr��OH��3����ȥ���������Һ��pH��ΧΪ ��
���𰸡�
��1��Na2CO3+2SO2�TNa2S2O5+CO2
��2��Na2S2O5��ˮ��Ӧ����NaHSO3 �� NaHSO3��ˮ�е���ʹ��Һ�����ԣ���pH�ƣ�����ȼƣ���pH���������ⶨ��Na2SO3
��3������һ������Ĺ�����c1mol?L��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2mol?L��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ������
��4��Na2S2O5��FeSO4?7H2O��Cr2O72����Ӧʱ������H+ �� ʹ��Һ��pH���pH��5.6
���������⣺��1��Na2CO3��SO2��Ӧ����Na2S2O5��CO2 �� ����Ԫ���غ��֪��ѧ����ʽΪNa2CO3+2SO2�TNa2S2O5+CO2 �� ���Դ��ǣ�Na2CO3+2SO2�TNa2S2O5+CO2����2��Na2S2O5��ˮ��Ӧ����NaHSO3 �� NaHSO3��ˮ�е���̶ȴ���ˮ��̶ȣ����Ի�ʹ��Һ�����ԣ��ⶨ��ҺpHֵ��ȷ��Ϊ0.1������pH�ƣ�����ȼƣ���pH���������ȣ���Na2CO3��Һ��ͨ��SO2��pHΪ4.1������NaHSO3��Һ����pH��4.1ʱ������Һ�л�����������ƣ�����Ʒ�л��и�����Na2SO3 ��
���Դ��ǣ�Na2S2O5��ˮ��Ӧ����NaHSO3 �� NaHSO3��ˮ�е���ʹ��Һ�����ԣ���pH�ƣ�����ȼƣ���pH���������ⶨ��Na2SO3����3������������ԭ�ζ���ԭ������Na2S2O5��Һ�м�������ı�����Һ��ʹNa2S2O5�����������ʣ��ı�����Һ���ñ�Na2S2O3��Һ�ζ������ݼ���ĵ����������Na2S2O3��Һ��Ӧ�ĵ�������������Na2S2O5��Ӧ�ĵ����������ȷ��Na2S2O5������������һԭ����֪ʵ���������Ϊ������һ������Ĺ�����c1 molL��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2 molL��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ��������
���Դ��ǣ�����һ������Ĺ�����c1 molL��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2 molL��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ����������4����Na2S2O5��FeSO47H2O�Ⱥ�������δ�����Cr2O72���ķ�ˮʱ�������������ӣ�������Һ��pHֵ���������Դ��ǣ�Na2S2O5��FeSO47H2O��Cr2O72����Ӧʱ������H+ �� ʹ��Һ��pH���c��Cr3+����1.0��10��5 molL��1ʱ������Ksp[Cr��OH��3]�������Һ��c��OH����= ![]() =
= ![]() ��10��9 molL��1 �� ����c��H+��=
��10��9 molL��1 �� ����c��H+��= ![]() ��������Һ��PH=��lgc��H+����5.6�����Խ���ˮ��Cr2O72��ȫ��ת��ΪCr��OH��3����ȥ���������Һ��pH��5.6�����Դ��ǣ�pH��5.6��
��������Һ��PH=��lgc��H+����5.6�����Խ���ˮ��Cr2O72��ȫ��ת��ΪCr��OH��3����ȥ���������Һ��pH��5.6�����Դ��ǣ�pH��5.6��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�