题目内容
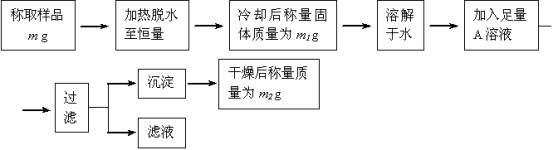
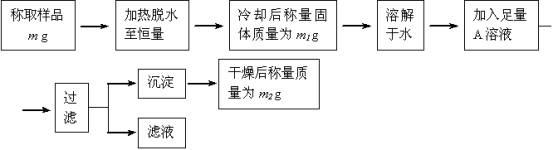
要同时测定混有少量氯化钠杂质的芒硝(Na2SO4•nH2O)的纯度和结晶水含量,按下列流程实验:
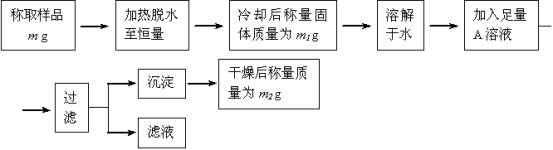
试回答:
(1)加热脱水时,若有固体飞溅出来造成损失,则会使测得的结晶水的含量偏 。
加热脱水后,若将样品于空气中冷却,则会使测得的结晶水的含量偏 。
(2)现有硝酸银、氯化钡、氯化钙、硝酸钡、氢氧化钡五种溶液,从测定的准确性考虑,可作为A溶液的分别是 ;若加入A溶液的量不足,会使测得的纯度偏 ;判断A溶液是否足量的方法是 。
(3)过滤时,应把滤纸上的沉淀洗涤干净,洗涤沉淀的方法是 ,若不洗涤,则会使测得的纯度偏 。
(4)通过实验,测得芒硝化学式中的n值为10,则芒硝的纯度 。
解析:
(1)高;低 (2)BaCl2、Ba(NO3)2、Ba(OH)2;低;向溶液中滴入A溶液,若有沉淀生成,则说明加入A溶液的量不足,反之,则说明加入A溶液已足量。 (3)向漏斗中的沉淀上加水至浸没沉淀,待水滤出,重复操作数次即可;高。 (4)
|
提示:
(1)结晶水含量的计算式为: (2)由于硫酸银、硫酸钙微溶于水,而硫酸钡不溶于水,故选择含有Ba2+的试剂可保证SO (3)过滤时,沉淀上可能挂有滤液,应用蒸馏水冲洗,方法是:向漏斗中的沉淀上加水至浸没沉淀,使滤液随水滤出,重复操作数次即可将沉淀上挂着的滤液基本除净。若不洗涤,会使沉淀的质量增大,导致测得的纯度偏高。 (4)Na2SO4•10H2O ~ BaSO4 322 233 x m2
芒硝的纯度=
|