题目内容
2SO2(g)+ O2(g) 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
⑴Ea的大小对该反应的△H _______(填“有”或“无”)影响。
⑵已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:___________ ________,常温常压下,由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 。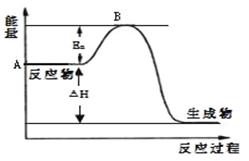
 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:⑴Ea的大小对该反应的△H _______(填“有”或“无”)影响。
⑵已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:___________ ________,常温常压下,由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 。

⑴无 ⑵S(s)+ O2(g)="=" SO2(g)△H =-296kJ·mol-1 1185kJ
(1)Ea表示反应的活化能,活化能的大小与反应热大小无关系。
(2)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以该反应的热化学方程式是S(s)+ O2(g)="=" SO2(g)△H =-296kJ·mol-1。
(3)根据盖斯定律可知,S(s)+3/2 O2(g)="=" SO3(g)△H =-395kJ·mol-1。 所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
(2)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以该反应的热化学方程式是S(s)+ O2(g)="=" SO2(g)△H =-296kJ·mol-1。
(3)根据盖斯定律可知,S(s)+3/2 O2(g)="=" SO3(g)△H =-395kJ·mol-1。
 所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 O2(气)=CO(气); △H ="-393.5" kJ/mol
O2(气)=CO(气); △H ="-393.5" kJ/mol 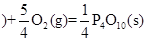 △H = —738.5kJ?mol-1
△H = —738.5kJ?mol-1
 在光照和点燃条件下的
在光照和点燃条件下的 不同
不同