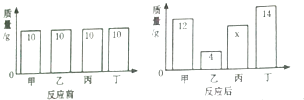
��Ŀ����
����Ŀ�������к���C��N��Mn��Ԫ�أ�ʵ���г��ù��������������ⶨ�������̵ĺ�������Ӧԭ��Ϊ2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
��1��Mnԭ�ӵļ۲���ӵĹ���Դ�ʽ�������Ų�ͼ��Ϊ______��
��2����֪H2S2O8�Ľṹ��ʽ��ͼ��ʾ��
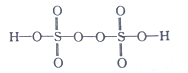
��H2S2O8��S�Ĺ���ӻ���ʽΪ______��H��O��S����Ԫ���У��縺������Ԫ����_________����Ԫ�ط��ţ���
��S��̬ԭ���е��ӵ��˶�״̬��_________�֡�
��������Ӧ��S2O82-���ѵĹ��ۼ�����Ϊ________������Ҽ����м���) ��ÿ����1molMnO4-,���ѵĹ��ۼ���ĿΪ_________NA��
��3��C��N���γɶ��ֽṹ�ľ��塣һ�����͵ij�Ӳ���������ڽ��ʯ�Ľṹ����Ӳ�ȱȽ��ʯ���侧����ͼ��ʾ��ͼʾԭ�Ӷ������ھ����ڣ����仯ѧʽΪ________����֪��������a=0.64nm, b=0.55nm��c=0.24nm����þ�����ܶ�Ϊ________���г�ʽ�Ӽ��ɣ���ʽ���в�������ĸ��g/cm3��
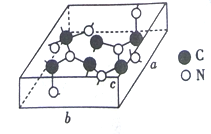
���𰸡� ![]() sp3 O 16 �Ҽ� 2.5 C3N4
sp3 O 16 �Ҽ� 2.5 C3N4 ![]()
����������1��Mnԭ�ӵļ۲���ӵĹ������ʽ�������Ų�ͼ��Ϊ![]() ����2����H2S2O8��S��4��Oԭ���γ�4������������ӻ���ʽΪsp3��ͬ�������϶��µ�һ�����ܼ�С��H��O��S����Ԫ���У��縺������Ԫ����O����SԪ��Ϊ16��Ԫ�أ�ԭ�Ӻ�����16�����ӣ�ÿ�����ӵ��˶�״̬����ͬ������16�ֲ�ͬ�ĵ�������������Ӧ��S2O82-���ѵĹ��ۼ�����Ϊ������������ ��2Mn2++5S2O82-+8H2O
����2����H2S2O8��S��4��Oԭ���γ�4������������ӻ���ʽΪsp3��ͬ�������϶��µ�һ�����ܼ�С��H��O��S����Ԫ���У��縺������Ԫ����O����SԪ��Ϊ16��Ԫ�أ�ԭ�Ӻ�����16�����ӣ�ÿ�����ӵ��˶�״̬����ͬ������16�ֲ�ͬ�ĵ�������������Ӧ��S2O82-���ѵĹ��ۼ�����Ϊ������������ ��2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+��ÿ����2molMnO4-,����5mol���ۼ�����ÿ����1molMnO4-,���ѵĹ��ۼ���ĿΪ2.5NA����3����������6��C��8��N���ʻ�ѧʽΪC3N4����=m/V=
2MnO4-+10SO42-+16H+��ÿ����2molMnO4-,����5mol���ۼ�����ÿ����1molMnO4-,���ѵĹ��ۼ���ĿΪ2.5NA����3����������6��C��8��N���ʻ�ѧʽΪC3N4����=m/V=![]() ��
��

����Ŀ��Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ����������о�����Ч���ƿ����еĵ������̼������ĺ����Ե���Ϊ��Ҫ��
I.���������о�
��1��һ�������£���2molNO��2molO2���ں����ܱ������з�����Ӧ2NO(g)+O2(g)![]() 2NO2(g)�����и�����˵����Ӧ�ﵽƽ��״̬���� ________________������ĸ���ţ� ��
2NO2(g)�����и�����˵����Ӧ�ﵽƽ��״̬���� ________________������ĸ���ţ� ��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��NO��O2�����ʵ���֮�ȱ��ֲ��� d��ÿ����1 molO2ͬʱ����2 molNO2
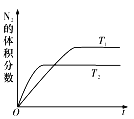
��2��������ȼ������ʱ������N2��O2�ķ�Ӧ��N2 +O2![]() 2NO���ǵ�������β���к���NO��ԭ��֮һ����T1��T2�¶��£�һ������NO�����ֽⷴӦʱN2�����������ʱ��仯����ͼ��ʾ������ͼ���жϷ�ӦN2(g)+O2(g)
2NO���ǵ�������β���к���NO��ԭ��֮һ����T1��T2�¶��£�һ������NO�����ֽⷴӦʱN2�����������ʱ��仯����ͼ��ʾ������ͼ���жϷ�ӦN2(g)+O2(g)![]() 2NO(g)����H__________0(����������������)��
2NO(g)����H__________0(����������������)��
����̼�������о�
��1������ɱ䣨����������֮���Ħ�������Բ��ƣ����ܱ���������ͼ��ʾ���ֽ�3molH2��2molCO���������У��ƶ����������VΪ2L����í���̶���A��B�㣬�����ϳɼ״��ķ�Ӧ���£�CO(g)+2H2(g)![]() CH3OH(g)��
CH3OH(g)��
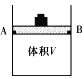
�ⶨ��ͬ��������ͬʱ����ڵ�CO��ת���ʣ��õ��������ݣ�
T������ | 10min | 20min | 30min | 40min |
T1 | 20% | 55% | 65% | 65% |
T2 | 35% | 50% | a1 | a2 |
�������ϱ����ݣ���Ƚ�T1_________T2(ѡ����>������<������=��)��T2���£���30min ʱ��a1=________�����¶��µĻ�ѧƽ�ⳣ��Ϊ__________________��
��T2���£���40minʱ����ȥí���������ܷ������ã�����û�з����ƶ�������������ͨ��6molCO����ʱv(����________v(�棩(ѡ����>������<������=��)��
��2��һ�������¿��ü״���CO��Ӧ���ɴ�������CO��Ⱦ�������£���a mol/L�Ĵ�����b mol/L Ba(OH)2��Һ��������(��Ϻ���Һ����仯���Բ��ƣ�����ַ�Ӧ����Һ�д���2c(Ba2+)��c(CH3COO-)���������Һ�еĵ��ƽ���֪����Һ��pH=___________��������������ĵ��볣��Ka =____________ (�ú�a��b�Ĵ���ʽ��ʾ����
����Ŀ��25��ʱ������ƽ�ⳣ����
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | 3.0��10��8 |
�ش��������⣺
��1����һ�����£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
a����������0.10mol��L��1��ϡ����
b������ c����ˮϡ����0.010mol��L��1
d���������������� e�����������Ȼ��ƹ���
f����������0.10mol��L��1��NaOH��Һ
��2��������0.1mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ����С����___________��
A��c��H+�� B��c��H+��/c��CH3COOH��
C��c��H+��c��OH���� D��c��OH����/c��H+��
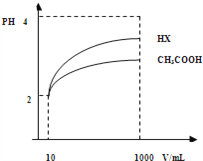
��3�����Ϊ10mLpH=2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX�ĵ���ƽ�ⳣ��_____������ڡ��������ڡ���С�ڡ��������ƽ�ⳣ����������_____________________��ϡ�ͺ�HX��Һ��ˮ���������c��H+��____������Һˮ�������c��H+��������ڡ��������ڡ���С�ڡ��������ǣ�_________________________��
��4��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c��CH3COO������c��Na+��=_________________����ȷ��ֵ����