题目内容
下列解释实验现象的反应方程式正确的是
- A.SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO4+H2O
- B.向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72-+H2O?2CrO42-+2H+
- C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
- D.铝热反应的原理为:Al2O3+2Fe
 2Al+Fe2O3
2Al+Fe2O3
分析:A.反应生成亚硫酸钠和水;
B.加入少量NaOH浓溶液,使Cr2O72-+H2O?2CrO42-+2H+平衡正向移动;
C.1:2体积比混合,生成硫酸钡、氢氧化铝、一水合氨;
D.铝热反应为Al与金属氧化物反应.
解答:A.SO2通入到滴加酚酞的NaOH溶液中,红色变浅的反应为SO2+2NaOH=Na2SO3+H2O,故A错误;
B.加入少量NaOH浓溶液,使Cr2O72-+H2O?2CrO42-+2H+平衡正向移动,溶液由橙色变为黄色,故B正确;
C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3.H2O,故C错误;
D.铝热反应的原理为:2Al+Fe2O3
 Al2O3+2Fe,故D错误;
Al2O3+2Fe,故D错误;故选B.
点评:本题考查较为综合,涉及平衡移动、化学反应及离子反应的书写,明确发生的化学反应是解答本题的关键,注意选项C为解答的难点,题目难度中等.

| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | --- |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
(3)实验室溶解该熔融物,下列试剂中最好的是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
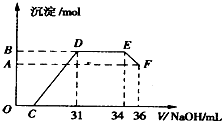
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.为了测定熔融物中两种金属的物质的量之比,某同学取一定量上述的熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)逐滴加入4mol/L的氢氧化钠溶液的定量玻璃仪器
(2)由上述图形分析可知,溶液中结合OH-能力最强的离子是
(3)通过如图数据试计算,熔融物中两种金属的物质的量之比n(Fe):n(Al)=
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
(3)实验室溶解该熔融物,下列试剂中最好的是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
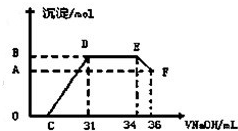
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.则B点对应的沉淀的物质的量为
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
反应的离子方程式为
(3)实验室溶解该熔融物,下列试剂中最好的是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
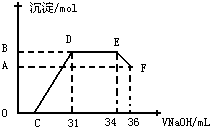
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
(3)B点对应的沉淀的物质的量为
物 质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | — |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:___________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中是否含有金属铝。该实验所用试剂是_____________,可能发生反应的离子方程式为______________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是___________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积 (mL)与产生的沉淀的物质的量(mol)的关系如下图所示。试回答下列问题:
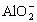
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为______________________。
(5)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________;上述现象说明溶液中____________结合OH-的能力比__________强(填离子符号)。
(6)B与A的差值为_________mol。
(7)B点对应的沉淀的物质的量为____________mol,C点对应的氢氧化钠溶液的体积为___________mL。
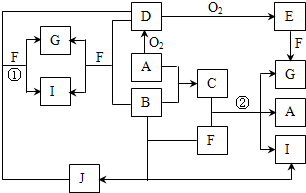 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O