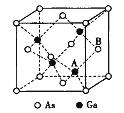
题目内容
【题目】A+、B+、C-、D、E5种微粒(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①A++C-=D+E;②B++C-=2D。据此,回答下列问题:
(1)上述含10电子的四核阳离子为___________,含10电子的阴离子为_______。
(2)A+和B+的电子式A+____________、B+____________。
(3)C-、D、E3种粒子结合质子H+的能力由强到弱的顺序是(用粒子的化学式表示)____________________;这一顺序可用以下离子方程式加以说明:
①_____________________________________________;
②_____________________________________________。
【答案】H3O+ OH- 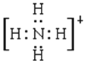
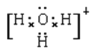 OH->NH3>H2O NH4++OH-=NH3H2O NH3+H3O+=NH4++H2O
OH->NH3>H2O NH4++OH-=NH3H2O NH3+H3O+=NH4++H2O
【解析】
A+、B+、C-、D、E为5种微粒(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①A++C-=D+E,②B++C-=2D,因此A+、B+、C-、D、E分别是NH4+、H3O+、OH-、H2O、NH3,据此分析解答。
根据以上分析可知A+、B+、C-、D、E分别是NH4+、H3O+、OH-、H2O、NH3,则
(1)上述含10电子的四核阳离子为H3O+,含10电子的阴离子为OH-。
(2)A+和B+分别是NH4+、H3O+,电子式分别是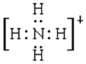 、
、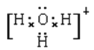 。
。
(3)反应NH4++OH-=NH3H2O可证明结合质子(H+)的能力OH->NH3,反应NH3+H3O+=NH4++H2O可证明结合质子(H+)的能力NH3>H2O,由此可以确定OH-、NH3、H2O结合氢离子的能力为:OH->NH3>H2O。

【题目】阿司匹林(乙酰水杨酸,![]() )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
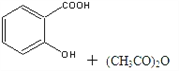
![]()

制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是_____________________。
(2)合成阿司匹林时,最合适的加热方法是_________________________。
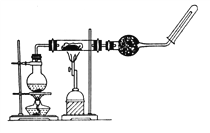
(3)提纯粗产品流程如下,加热回流装置如图:
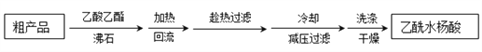
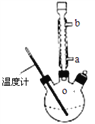
①使用温度计的目的是是控制加热的温度,防止_____________________________。
②冷凝水的流进方向是______________(填“a”或“b”);
③趁热过滤的原因是_________________________________________________。
④下列说法正确的是__________(填选项字母)。
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(![]() ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 ___________(用百分数表示,小数点后一位)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 ___________(用百分数表示,小数点后一位)。