题目内容
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E、F的简单离子半径由大到小的顺序是(用化学符号表示)______;
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式______;
(4)用电子式表示B2F的形成过程______
(5)A、B形成的化合物BA可以夺取很多化合物中的质子而生成相应的钠化合物.写出它与水反应的化学方程式______在方程式中用单线桥标明电子转移的方向和数目
(6)写出D的最高价氧化物的一点用途______.
【答案】分析:A的单质是密度最小的物质,故A是氢元素;
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;
C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;
D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂的主要成分是次氯酸钠,所以E是氯元素;
F元素最高正价与最低负价的代数和为4,且F是短周期元素,所以F是硫元素;
结合元素对应单质和化合物的性质以及题目要求解答该题.
解答:解:A的单质是密度最小的物质,故A是氢元素;
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;
C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;
D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂的主要成分是次氯酸钠,所以E是氯元素;
F元素最高正价与最低负价的代数和为4,且F是短周期元素,所以F是硫元素;
(1)化合物Y为次氯酸钠,次氯酸钠中钠离子和次氯酸根离子之间存在离子键,次氯酸根离子中氯原子和氧原子之间存在共价键,
故答案为:离子键、共价键(极性共价键);
(2)铝离子的电子层数小于硫离子、氯离子的电子层数,电子层数越多,离子半径越大,所以铝离子半径小于氯离子和硫离子半径;电子层数相同的离子,离子半径随着原子序数的增大而减小,所以硫离子半径大于氯离子半径,则为S2->Cl->Al3+,
故答案为:S2->Cl->Al3+;
(3)两种均含A、B、C、F四种元素的化合物分别为硫酸氢钠和亚硫酸氢钠,硫酸氢钠溶液呈强酸性,亚硫酸氢钠是弱酸酸式盐,所以硫酸氢钠和亚硫酸氢钠反应产生硫酸钠、水和二氧化硫,反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(4)B2F为Na2S,用电子式形成过程为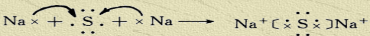 ,
,
故答案为: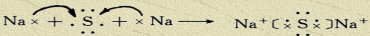 ;
;
(5)A、B形成的化合物NaH,可与水反应生成NaOH和氢气,反应中NaH为还原剂,水为氧化剂,反应的方程式以及电子转移方向为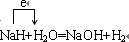 ,故答案为:
,故答案为: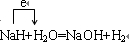 ;
;
(6)D的最高价氧化物为Al2O3,常用于工业冶炼铝的原料,故答案为:工业冶炼铝.
点评:本题考查了元素的推断、离子半径的半径、化学键的判断等知识点,易错的(3)题,注意把握对应物质的性质.
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;
C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;
D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂的主要成分是次氯酸钠,所以E是氯元素;
F元素最高正价与最低负价的代数和为4,且F是短周期元素,所以F是硫元素;
结合元素对应单质和化合物的性质以及题目要求解答该题.
解答:解:A的单质是密度最小的物质,故A是氢元素;
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;
C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;
D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂的主要成分是次氯酸钠,所以E是氯元素;
F元素最高正价与最低负价的代数和为4,且F是短周期元素,所以F是硫元素;
(1)化合物Y为次氯酸钠,次氯酸钠中钠离子和次氯酸根离子之间存在离子键,次氯酸根离子中氯原子和氧原子之间存在共价键,
故答案为:离子键、共价键(极性共价键);
(2)铝离子的电子层数小于硫离子、氯离子的电子层数,电子层数越多,离子半径越大,所以铝离子半径小于氯离子和硫离子半径;电子层数相同的离子,离子半径随着原子序数的增大而减小,所以硫离子半径大于氯离子半径,则为S2->Cl->Al3+,
故答案为:S2->Cl->Al3+;
(3)两种均含A、B、C、F四种元素的化合物分别为硫酸氢钠和亚硫酸氢钠,硫酸氢钠溶液呈强酸性,亚硫酸氢钠是弱酸酸式盐,所以硫酸氢钠和亚硫酸氢钠反应产生硫酸钠、水和二氧化硫,反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(4)B2F为Na2S,用电子式形成过程为
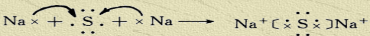 ,
,故答案为:
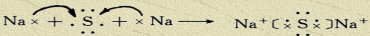 ;
;(5)A、B形成的化合物NaH,可与水反应生成NaOH和氢气,反应中NaH为还原剂,水为氧化剂,反应的方程式以及电子转移方向为
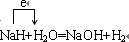 ,故答案为:
,故答案为: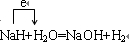 ;
;(6)D的最高价氧化物为Al2O3,常用于工业冶炼铝的原料,故答案为:工业冶炼铝.
点评:本题考查了元素的推断、离子半径的半径、化学键的判断等知识点,易错的(3)题,注意把握对应物质的性质.

练习册系列答案
相关题目





