题目内容
【题目】原子序数小于36的X、Y、Z、W四种元素,其中X形成的单质是最轻的物质,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29回答下列问题:
(1)Y2X2中Y原子的杂化类型为 ______ ,1molY2X2含有![]() 键的数目为 ______ 。
键的数目为 ______ 。
(2)Y的一种氧化物与Z的一种氧化物互为等电子体,Z的这种氧化物分子式是 ______ 。
(3)标准状况2.24LZ的简单氢化物溶于Z的最高价氧化物的水化物稀溶液,放热QkJ,该反应的热化学方程式为 ______。
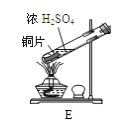
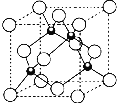
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ______ ,氯化物晶体溶于足量Z的最高价氧化物的水化物的浓溶液反应的离子方程式为 ______。
【答案】sp杂化 3×6.02×1023 N2O ![]() CuCl
CuCl ![]()
【解析】
原子序数小于36的X、Y、Z、W四种元素,其中X是形成的单质是最轻的物质,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;W的原子序数为29,则W是Cu元素,据此分析解答。
(1)Y2X2是乙炔,分子式为C2H2,碳氢原子之间存在![]() 键,碳碳三键中含有一个
键,碳碳三键中含有一个![]() 键,所以每个碳原子含有2个
键,所以每个碳原子含有2个![]() 键,采取sp杂化,一个乙炔分子中含有3个
键,采取sp杂化,一个乙炔分子中含有3个![]() 键,所以1mol Y2X2含有
键,所以1mol Y2X2含有![]() 键3×6.02×1023个;
键3×6.02×1023个;
(2)CO2和N2O的原子个数相等、价电子数相等,所以是等电子体;
(3)Z的简单氢化物为氨气,Z的最高价氧化物的水化物稀溶液为稀硝酸,标准状况2.24L氨气为0.1mol,溶于稀硝酸放热QkJ,则1mol氨气反应放出热量为10QkJ,该反应的热化学方程式为:![]() ;
;
(4)利用均摊法知,该晶胞中黑色球个数=4,白色球个数=![]() ×8+
×8+![]() ×6=4,黑色球和白色球的个数之比=4:4=1:1,所以该物质的化学式是CuCl,它可与浓硝酸发生氧化还原反应,其反应方程式为:
×6=4,黑色球和白色球的个数之比=4:4=1:1,所以该物质的化学式是CuCl,它可与浓硝酸发生氧化还原反应,其反应方程式为:![]() 。
。

【题目】现有部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第________周期______族;
(2)元素Y的原子结构示意图为________。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应