题目内容
下列图像表达正确的是
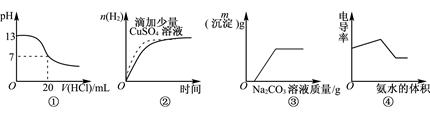

| A.图①表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向盐酸和醋酸混合溶液中滴入氨水 |
C
A中在PH=7附近,应该有一个pH的突变,即多一滴或少一滴盐酸PH值变化较大,而图像中变化较平缓,故A错误;
等量锌粉与足量等体积等浓度的盐酸,则生成H2的物质的量由锌粉决定,当滴加少量CuSO4溶液时,Zn+CuSO4=Cu+ZnSO4,构成铜-锌原电池,能加快反应速率(斜率增大),但因为消耗了锌,故生成H2的物质的量应减少(即最后不应是同一条平行线),故B错误;
先2HCl+Na2CO3=2NaCl+H2O+CO2↑(此段无沉淀生成),后CaCl2+ Na2CO3=2NaCl+CaCO3↓(此段沉淀逐渐增多),CaCl2耗尽后,再加Na2CO3无变化,故C正确;
D、电导率与溶液中的离子浓度有关,离子浓度越大,则电导率越大,
先HCl+NH3.H2O=NH4Cl+H2O(相当于将HCl换成NH4Cl,离子浓度变化不大,则电导率变化不大),后CH3COOH+ NH3.H2O=CH3COONH4+H2O(相当于将CH3COOH换成CH3COONH4,离子浓度增大,则电导率增大),盐酸和醋酸耗尽后,再滴入氨水,相当于加水稀释,则离子浓度减小,电导率减小,故图像应先上升后降低,故D错误;
等量锌粉与足量等体积等浓度的盐酸,则生成H2的物质的量由锌粉决定,当滴加少量CuSO4溶液时,Zn+CuSO4=Cu+ZnSO4,构成铜-锌原电池,能加快反应速率(斜率增大),但因为消耗了锌,故生成H2的物质的量应减少(即最后不应是同一条平行线),故B错误;
先2HCl+Na2CO3=2NaCl+H2O+CO2↑(此段无沉淀生成),后CaCl2+ Na2CO3=2NaCl+CaCO3↓(此段沉淀逐渐增多),CaCl2耗尽后,再加Na2CO3无变化,故C正确;
D、电导率与溶液中的离子浓度有关,离子浓度越大,则电导率越大,
先HCl+NH3.H2O=NH4Cl+H2O(相当于将HCl换成NH4Cl,离子浓度变化不大,则电导率变化不大),后CH3COOH+ NH3.H2O=CH3COONH4+H2O(相当于将CH3COOH换成CH3COONH4,离子浓度增大,则电导率增大),盐酸和醋酸耗尽后,再滴入氨水,相当于加水稀释,则离子浓度减小,电导率减小,故图像应先上升后降低,故D错误;

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
某溶液中有Na+、NH4+、Al3+、Fe2+等四种阳离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中离子数目几乎不变的阳离子是
| A.Na+ | B.NH4+ | C.Al3+ | D.Fe2+ |