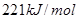题目内容
(12分)按要求回答下列问题
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②锥形瓶用蒸馏水洗净后没有用待测液润洗
③用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
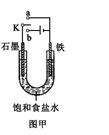
(2)某课外活动小组同学用右图甲装置进行实验,试答下列问题:
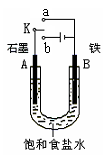
①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)= ___________ mol/L。
(4)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是 ,只能电离不能水解的离子是 ,既能电离又能水解的离子是 ,写出能水解离子的水解离子方程式 , 。
(5)已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,测得某溶液的pH = 13,则此温度下溶液中的c(Mg2+) = ____________________。

(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②锥形瓶用蒸馏水洗净后没有用待测液润洗
③用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用右图甲装置进行实验,试答下列问题:

①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)= ___________ mol/L。
(4)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是 ,只能电离不能水解的离子是 ,既能电离又能水解的离子是 ,写出能水解离子的水解离子方程式 , 。
(5)已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,测得某溶液的pH = 13,则此温度下溶液中的c(Mg2+) = ____________________。
(1)③⑤(2分)
(2)①吸氧(1分) ②2Cl-+2H2O H2↑+C12↑+2OH-(2分)
H2↑+C12↑+2OH-(2分)
(3)10-8 (1分)
(4)Al3+,(1分) HSO4-(1分) HS-(1分)
Al3+ +3 H2O Al(OH)3 +3H+(1分) HS- + H2O
Al(OH)3 +3H+(1分) HS- + H2O H2S + OH-(1分)
H2S + OH-(1分)
(5) 5.6×10-10mol·L-1(1分)
(2)①吸氧(1分) ②2Cl-+2H2O
 H2↑+C12↑+2OH-(2分)
H2↑+C12↑+2OH-(2分)(3)10-8 (1分)
(4)Al3+,(1分) HSO4-(1分) HS-(1分)
Al3+ +3 H2O
 Al(OH)3 +3H+(1分) HS- + H2O
Al(OH)3 +3H+(1分) HS- + H2O H2S + OH-(1分)
H2S + OH-(1分)(5) 5.6×10-10mol·L-1(1分)
(1)用标准NaOH溶液滴定未知浓度的盐酸,C(HCl)=[C(NaOH)V(NaOH)]/V(HCl),在向关系式中带数时,C(NaOH)、V(HCl)均为定值,所以一切问题均归到碱式滴定管的读数:
①的操作实际导致C(NaOH)减小,则消耗V(NaOH)增大,故C(HCl)增大;
②无影响;
③的操作导致C(HCl)减小;
④的操作导致V(NaOH)增大,故C(HCl)增大;
⑤的操作导致V2减小,则V(NaOH)=V2-V1减小,故C(HCl)减小;
(3)因为HA+NaOH=NaA+H2O,故0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合后将变为0.05 mol/L的NaA溶液,pH=8说明NaA为强碱弱酸盐,A-水解呈碱性(A-+ H2O HA + OH-);
HA + OH-);
利用质子守恒,得:c(OH-) =c(HA) + c(H+),则c(OH-)-c(HA)=c(H+)=10-8mol·L-1;
(5)Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
Ksp = c(Mg2+)× c2(OH-) = 5.6×10-12,pH = 13则c(OH-) =10-1mol·L-1,
带入Ksp得c(Mg2+)=5.6×10-10mol·L-1
①的操作实际导致C(NaOH)减小,则消耗V(NaOH)增大,故C(HCl)增大;
②无影响;
③的操作导致C(HCl)减小;
④的操作导致V(NaOH)增大,故C(HCl)增大;
⑤的操作导致V2减小,则V(NaOH)=V2-V1减小,故C(HCl)减小;
(3)因为HA+NaOH=NaA+H2O,故0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合后将变为0.05 mol/L的NaA溶液,pH=8说明NaA为强碱弱酸盐,A-水解呈碱性(A-+ H2O
 HA + OH-);
HA + OH-);利用质子守恒,得:c(OH-) =c(HA) + c(H+),则c(OH-)-c(HA)=c(H+)=10-8mol·L-1;
(5)Mg(OH)2(s)
 Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)Ksp = c(Mg2+)× c2(OH-) = 5.6×10-12,pH = 13则c(OH-) =10-1mol·L-1,
带入Ksp得c(Mg2+)=5.6×10-10mol·L-1

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
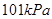 时,
时,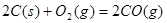 ;
;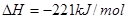
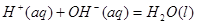 ;
;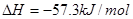
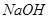 溶液反应生成
溶液反应生成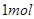 水,放出
水,放出 热量
热量