题目内容
反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
(1)2NaI+MnO2+3H2SO4====2NaHSO4+MnSO4+2H2O+I2
(2)2NaIO3+5NaHSO3====2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)中是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2>![]() >
>![]() >I2
>I2
D.反应(1)、(2)中生成等量的I2时转移电子数比为1∶5
D
解析:
首先标化合价看价变化:
2Na![]() +
+![]() O2+3H2SO4====2NaHSO4+
O2+3H2SO4====2NaHSO4+![]() SO4+2H2O+
SO4+2H2O+![]() ,I的化合价升高,I2是氧化产物,NaHSO4中的元素化合价没有变化,既不是氧化产物也不是还原产物,氧化性:MnO2>I2,生成1 mol I2转移2 mol电子;
,I的化合价升高,I2是氧化产物,NaHSO4中的元素化合价没有变化,既不是氧化产物也不是还原产物,氧化性:MnO2>I2,生成1 mol I2转移2 mol电子;
![]() ====
====![]() ,I的化合价降低,I2是还原产物,Na2SO4、NaHSO4是氧化产物,氧化性:
,I的化合价降低,I2是还原产物,Na2SO4、NaHSO4是氧化产物,氧化性:![]() >
>![]() ,生成1 mol I2转移10 mol电子。
,生成1 mol I2转移10 mol电子。

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
|
反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应: 2NaI+MnO2+3H2SO4 2NaIO3+5NaHSO3 下列说法正确的是 | |
| [ ] | |
A. |
两个反应中NaHSO4均为氧化产物 |
B. |
I2在反应(1)中是还原产物,在反应(2)中是氧化产物 |
C. |
氧化性:MnO2>SO42->IO3->I2 |
D. |
反应(1)、(2)中生成等量的I2时转移电子数之比为1∶5 |
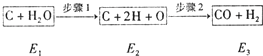 如图是炭和水蒸汽发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应.试问:
如图是炭和水蒸汽发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应.试问: 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2 2Na2SO4+3NaHSO4+H2O+I2
2Na2SO4+3NaHSO4+H2O+I2