题目内容
【题目】已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。
试回答下列有关的问题:
(1)写出基态D原子的外围电子排布式:__________________,E元素位于元素周期表__________________。
(2)A、B、C三种元素的第一电离能最大的是_________(用元素符号表示)。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______________________________ (写化学式)。
(3)D可形成化合物[D(H2O)6](NO3)3 。①[D(H2O)6](NO3)3中配位体的VSEPR模型名称是__________________。该化合物中阴离子的中心原子的轨道杂化类型为_________。
②1 个 [D(H2O)6]3+ 中含有的σ键数目为_________个。
(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中________(填化学式)为非极性分子,另一种化合物的电子式为_________。
(5)E+离子能与SCN-离子形成ESCN沉淀。SCN-离子对应的酸有硫氰酸(H―S―C≡N)和异硫氰酸(H―N=C=S),这两种酸沸点更高的是______________(填名称),原因是________________________。
(6)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的截面图,晶胞中距离一个A+最近的A+有_______个,距离一个A+最近的C-围成的图形是______________(写名称)。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则A+的半径为_________cm(用含NA与ρ的式子表达)。

【答案】 3d54s1 第四周期第IB族 Cl NaOH>H3PO4>HClO4 四面体形 sp2杂化 18 PCl5 ![]() 异硫氰酸 分子间能形成氢键 12 正八面体
异硫氰酸 分子间能形成氢键 12 正八面体 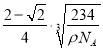
【解析】已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,A为Na元素,B元素3p能级半充满,B为P元素;C是所在周期电负性最大的元素,C为Cl元素;D是第四周期未成对电子最多的元素,价层电子排布式为3d54s1,D为Cr元素,E元素位于元素周期表的第11列,E为Cu元素。
(1)D为Cr元素,基态D原子的外围电子排布式为3d54s1,Cu元素位于元素周期表第四周期第IB族;(2)A、B、C三种元素中Cl的非金属性最强,最难失去电子,第一电离能最大的是Cl;这三种元素最高价氧化物的水化物形成的溶液分别是氢氧化钠、磷酸、高氯酸,物质的量浓度相同时,pH由大到小的顺序是NaOH>H3PO4>HClO4;(3)D可形成化合物[D(H2O)6](NO3)3。①[D(H2O)6](NO3)3中配位体为H2O,H2O中O采用sp3杂化,VSEPR模型是四面体形,该化合物中阴离子为NO3-,其中N原子的价层电子对数为3+![]() (5+1-2×3)=3,采用sp2杂化;②1个[D(H2O)6]3+中含有12个O-H共价键和6个配位键,σ键数目为18个;(3)已知B、C两种元素形成的化合物通常有三氯化磷和五氯化磷。三氯化磷为三角锥形结构,属于极性分子,五氯化磷是三角双锥结构,属于非极性分子,三氯化磷的电子式为
(5+1-2×3)=3,采用sp2杂化;②1个[D(H2O)6]3+中含有12个O-H共价键和6个配位键,σ键数目为18个;(3)已知B、C两种元素形成的化合物通常有三氯化磷和五氯化磷。三氯化磷为三角锥形结构,属于极性分子,五氯化磷是三角双锥结构,属于非极性分子,三氯化磷的电子式为![]() ;(4)SCN-离子对应的酸有硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中异硫氰酸分子间能形成氢键,沸点较高;(5)由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的Na+离子处于晶胞的棱上,共有12个,根据晶胞结构可知距离一个A+最近的C-围成的图形是正八面体;晶胞中Na+离子数目=1+12×
;(4)SCN-离子对应的酸有硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中异硫氰酸分子间能形成氢键,沸点较高;(5)由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的Na+离子处于晶胞的棱上,共有12个,根据晶胞结构可知距离一个A+最近的C-围成的图形是正八面体;晶胞中Na+离子数目=1+12×![]() =4,Cl-离子数目=8×
=4,Cl-离子数目=8×![]() +6×
+6×![]() =4,故晶胞质量=
=4,故晶胞质量=![]() g,晶胞体积=
g,晶胞体积= cm3=
cm3=![]() cm3,令Cl-离子半径为r,则棱长为
cm3,令Cl-离子半径为r,则棱长为![]() ×4r=2
×4r=2![]() r,故(2
r,故(2![]() r)3=
r)3=![]() cm3,解得r=
cm3,解得r=![]() ×
×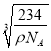 cm。
cm。

 阅读快车系列答案
阅读快车系列答案
