题目内容
在一容积为2L的密闭容器中,充入4mol氮气和12mol氢气,使其在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),2min末测得NH3为0.8mol,则:
(1)以N2的浓度变化表示该反应在2min内的平均反应速率为 ;
(2)H2在2min末的体积分数为 (保留两位有效数字);
(3)2min末N2的转化率为 ;
(4)已知在25℃,101kPa下,拆开1mol N2中的化学键需消耗946kJ的能量,拆开1mol H2中的H-H键要消耗436kJ的能量,而形成1mol N-H键会放出391kJ的能量.试通过以上数据计算当反应掉1molN2和3molH2生成2molNH3时会 (填“放出”或“吸收”) 热量;
(5)若将1mol N2和3molH2置于绝热密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于上述计算值,你认为最可能的原因是.
(1)以N2的浓度变化表示该反应在2min内的平均反应速率为
(2)H2在2min末的体积分数为
(3)2min末N2的转化率为
(4)已知在25℃,101kPa下,拆开1mol N2中的化学键需消耗946kJ的能量,拆开1mol H2中的H-H键要消耗436kJ的能量,而形成1mol N-H键会放出391kJ的能量.试通过以上数据计算当反应掉1molN2和3molH2生成2molNH3时会
(5)若将1mol N2和3molH2置于绝热密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于上述计算值,你认为最可能的原因是.
考点:化学平衡的计算,有关反应热的计算
专题:化学反应中的能量变化,化学平衡专题
分析:利用三段式可求得平衡时各成分的浓度,进而求得反应速率、体积分数、转化率,根据能量守恒可求得反应热,根据可逆反应的特点分析原因;
解答:
解:利用三段式
N2 +3H2 ?2NH3
?2NH3
起始量(mol/L) 2 6 0
变化量(mol/L) 0.2 0.6 0.4
2min量(mol/L) 1.8 5.4 0.4
(1)以N2的浓度变化表示该反应2min内的平均反应速率为
=0.1mol/(L?min),故答案为:0.1mol/(L?min);
(2)H2在2min末的体积分数为
×100%=71%,故答案为:71%;
(3)2min末N2的转化率为
×100%=10%,故答案为:10%;
(4)根据反应 N2 +3H2 ?2NH3可知,1mol N2和3molH2完全反应的热量变化=反应物键能之和-生成物键能之和=946kJ+436kJ×3-391kJ×6=-92kJ,故该反应的△H=-92kJ/mol,故该反应为放热反应,故答案为:放出;92kJ;
?2NH3可知,1mol N2和3molH2完全反应的热量变化=反应物键能之和-生成物键能之和=946kJ+436kJ×3-391kJ×6=-92kJ,故该反应的△H=-92kJ/mol,故该反应为放热反应,故答案为:放出;92kJ;
(5)若将1mol N2和3molH2置于绝热密闭容器中,并在上述条件下反应,由于反应 N2 +3H2 ?2NH3为可逆反应,即反应不能完全进行,也就是说1mol N2和3molH2未完全反应,所以产生的热量要远小于上述计算值,故答案为:反应 N2 +3H2
?2NH3为可逆反应,即反应不能完全进行,也就是说1mol N2和3molH2未完全反应,所以产生的热量要远小于上述计算值,故答案为:反应 N2 +3H2 ?2NH3为可逆反应,1mol N2和3molH2不能完全转化成2molNH3;
?2NH3为可逆反应,1mol N2和3molH2不能完全转化成2molNH3;
N2 +3H2
 ?2NH3
?2NH3起始量(mol/L) 2 6 0
变化量(mol/L) 0.2 0.6 0.4
2min量(mol/L) 1.8 5.4 0.4
(1)以N2的浓度变化表示该反应2min内的平均反应速率为
| 0.2mol/L |
| 2min |
(2)H2在2min末的体积分数为
| 5.4 |
| 1.8 +5.4+0.4 |
(3)2min末N2的转化率为
| 0.2 |
| 2 |
(4)根据反应 N2 +3H2
 ?2NH3可知,1mol N2和3molH2完全反应的热量变化=反应物键能之和-生成物键能之和=946kJ+436kJ×3-391kJ×6=-92kJ,故该反应的△H=-92kJ/mol,故该反应为放热反应,故答案为:放出;92kJ;
?2NH3可知,1mol N2和3molH2完全反应的热量变化=反应物键能之和-生成物键能之和=946kJ+436kJ×3-391kJ×6=-92kJ,故该反应的△H=-92kJ/mol,故该反应为放热反应,故答案为:放出;92kJ;(5)若将1mol N2和3molH2置于绝热密闭容器中,并在上述条件下反应,由于反应 N2 +3H2
 ?2NH3为可逆反应,即反应不能完全进行,也就是说1mol N2和3molH2未完全反应,所以产生的热量要远小于上述计算值,故答案为:反应 N2 +3H2
?2NH3为可逆反应,即反应不能完全进行,也就是说1mol N2和3molH2未完全反应,所以产生的热量要远小于上述计算值,故答案为:反应 N2 +3H2 ?2NH3为可逆反应,1mol N2和3molH2不能完全转化成2molNH3;
?2NH3为可逆反应,1mol N2和3molH2不能完全转化成2molNH3;
点评:本题主要考查化学平衡的相关计算以及可逆反应的特征的应用,难度中等,解题是要运用好三段式的计算方法以及概念计算的公式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
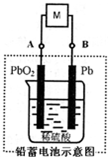 如图铅蓄电池是一种典型的可充电电池,电池总反应式为
如图铅蓄电池是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
| A、放电时,电流方向由B过M到A |
| B、充电时,铅蓄电池的正极应与充电器电源的负极相连 |
| C、放电时,正极反应是Pb-2e-+SO42-═PbSO4 |
| D、充电时,阳极反应是PbSO4-2e-+2H2O═PbO2+SO42-+4H+ |
乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为的同分异构体的类型为( )
| A、碳链异构 | B、位置异构 |
| C、官能团异构 | D、顺反异构 |
下列书写的离子方程式中,正确的是( )
| A、高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O |
| B、在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-→NH3?H2O |
| C、VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O→5VO2++Mn2++2H+ |
| D、Fe2+离子被空气氧化:4Fe2++O2+2H2O→4Fe3++4OH- |
下列各组物质,其中属于同系物的是( )
(1)乙烯和苯乙烯 (2)丙烯酸和油酸 (3)乙醇和丙二醇 (4)丁二烯与异戊二烯
(5)蔗糖与麦芽糖.
(1)乙烯和苯乙烯 (2)丙烯酸和油酸 (3)乙醇和丙二醇 (4)丁二烯与异戊二烯
(5)蔗糖与麦芽糖.
| A、(1)(2)(3)(4) |
| B、(2)(4) |
| C、(1)(2)(4)(5) |
| D、(1)(2)(4) |