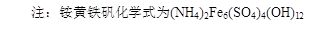题目内容
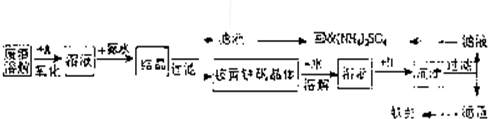
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下:

(1)在废渣溶解操作时,应选用
A、氨水 B、氢氧化钠 C、盐酸 D、硫酸
(2)物质A是一种氧化剂,工业上最好选用
(3)根据如图有关数据,你认为工业上氧化操作时应控制的条件是:
(4)“结晶”反应的化学方程式为

(1)在废渣溶解操作时,应选用
D
D
溶解(填字母).A、氨水 B、氢氧化钠 C、盐酸 D、硫酸
(2)物质A是一种氧化剂,工业上最好选用
空气
空气
供选择使用的有:空气、Cl2、MnO2),其理由是原料来源容易,成本低,不产生污染,不引入杂质
原料来源容易,成本低,不产生污染,不引入杂质
(3)根据如图有关数据,你认为工业上氧化操作时应控制的条件是:
溶液温度为80℃,pH为1.5,时间为4小时左右
溶液温度为80℃,pH为1.5,时间为4小时左右
.
(4)“结晶”反应的化学方程式为
3Fe2(SO4)3+12NH3?H2O=(NH4)2Fe6(SO4)4(OH)12↓+5 (NH4)2SO4
3Fe2(SO4)3+12NH3?H2O=(NH4)2Fe6(SO4)4(OH)12↓+5 (NH4)2SO4
.分析:(1)依据废渣成分结合提纯物质组成分析判断;
(2)氧化剂主要是用来 氧化亚铁离子,空气来源丰富经济效益高不产生污染等回答;
(3)依据图象分析,亚铁离子的氧化率最高是溶液温度为80℃,pH为1.5;
(4)依据流程图结合转化关系中的物质、反应试剂和得到产物化学式,依据原子守恒配平写出;
(2)氧化剂主要是用来 氧化亚铁离子,空气来源丰富经济效益高不产生污染等回答;
(3)依据图象分析,亚铁离子的氧化率最高是溶液温度为80℃,pH为1.5;
(4)依据流程图结合转化关系中的物质、反应试剂和得到产物化学式,依据原子守恒配平写出;
解答:解:(1)在废渣溶解操作时,目的是溶解氧化物,制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,不能引入杂质离子;
A、氨水不能溶解氧化物,能沉淀铁离子和亚铁离子,故A不选;
B、氢氧化钠溶液沉淀铁离子和亚铁离子不能溶解氧化钙、氧化镁,故B不选;
C、盐酸溶解氧化钙和氧化镁,但引入氯离子不能除去,故C不选;
D、硫酸能溶解氧化钙和氧化镁,且不引入杂质离子,故D符合;
故答案为:D;
(2)氧化剂主要是氧化亚铁离子便于提取,氯气有毒乙污染空气,二氧化锰是难溶于水的固体,空气来源丰富,成本低,不引入杂质,不产生污染;
故答案为:空气; 原料来源容易,成本低,不产生污染,不引入杂质;
(3)分析图象可知在80°C时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4小时左右;
故答案为:溶液温度为80℃,pH为1.5,时间为4小时左右;
(4))“结晶”反应是硫酸铁在氨水中反应生成铵黄铁帆和硫酸铵,依据原子守恒配平写出反应的化学方程式为3Fe2(SO4)3+12NH3?H2O=(NH4)2Fe6(SO4)4(OH)12↓+5 (NH4)2SO4;
故答案为:3Fe2(SO4)3+12NH3?H2O=(NH4)2Fe6(SO4)4(OH)12↓+5 (NH4)2SO4;
A、氨水不能溶解氧化物,能沉淀铁离子和亚铁离子,故A不选;
B、氢氧化钠溶液沉淀铁离子和亚铁离子不能溶解氧化钙、氧化镁,故B不选;
C、盐酸溶解氧化钙和氧化镁,但引入氯离子不能除去,故C不选;
D、硫酸能溶解氧化钙和氧化镁,且不引入杂质离子,故D符合;
故答案为:D;
(2)氧化剂主要是氧化亚铁离子便于提取,氯气有毒乙污染空气,二氧化锰是难溶于水的固体,空气来源丰富,成本低,不引入杂质,不产生污染;
故答案为:空气; 原料来源容易,成本低,不产生污染,不引入杂质;
(3)分析图象可知在80°C时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4小时左右;
故答案为:溶液温度为80℃,pH为1.5,时间为4小时左右;
(4))“结晶”反应是硫酸铁在氨水中反应生成铵黄铁帆和硫酸铵,依据原子守恒配平写出反应的化学方程式为3Fe2(SO4)3+12NH3?H2O=(NH4)2Fe6(SO4)4(OH)12↓+5 (NH4)2SO4;
故答案为:3Fe2(SO4)3+12NH3?H2O=(NH4)2Fe6(SO4)4(OH)12↓+5 (NH4)2SO4;
点评:本题考查了物质制备和提纯的实验流程分析判断,图象分析应用,化学方程式书写方法,题目信息量大需要仔细审题,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目