题目内容
【题目】按要求完成下列填空:
(1)11H、21H、31H互为________O2、O3互为_________
(2)在下列固体中: a.CaCl2 b.KOHc.Hed.H2SO4e.NH4Clf.金刚石
①其中不含化学键的物质是________
②既含有离子键又含有共价键的物质是____________(填序号)
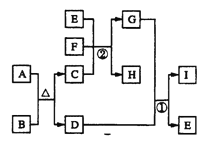
(3)下图是几种常见的电池装置。请回答:

①电池Ⅰ中负极反应式是_____,溶液中H+向_____(填“负”或“正”)极移动,若1mol电子流过导线,则产生氢气的物质的量是______mol。
②电池Ⅱ属于________电池(填“一次”或“二次”).
③电池Ⅲ是氢氧燃料电池,写出负极的电极反应式是________
【答案】 同位素 同素异形体 c be Zn-2e-=Zn2+ 0.5 二 二次 H2-2e-+2OH-=2H2O
【解析】(1)11H、21H、31H三种原子核电荷数相同,中子数不同,互为同位素;O2、O3为同种元素形成的不同性质的单质,互为同素异形体;正确答案:同位素 ; 同素异形体。
(2) CaCl2为离子化合物,只含有离子键;KOH为离子化合物,含有离子键和极性共价键;He为单原子分子,不存在化学键;H2SO4为共价化合物,存在共价键;NH4Cl为离子化合物,即有离子键,又有共价键;金刚石为原子晶体,存在共价键。
①综上所述,其中不含化学键的物质是c;正确答案:c。
②综上所述,既含有离子键又含有共价键的物质是be;正确答案:be。
(3)①锌比铜活泼,锌做负极,发生氧化反应,极反应为Zn-2e-=Zn2+;正确答案:Zn-2e-=Zn2+。溶液中的H+向铜电极即正极移动;根据2H++2e-=H2↑可知,若1mol电子流过导线,产生氢气的量为0.5 mol;正确答案:Zn-2e-=Zn2+;正;0.5。
②电池Ⅱ为铅蓄电池,可充电和放电,属于二次电池;正确答案:二次。
③电池Ⅲ是氢氧燃料电池,氢气做负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O;正确答案:H2-2e-+2OH-=2H2O。

 阅读快车系列答案
阅读快车系列答案