题目内容
向100ml 2mol/L AlCl3溶液中加入了100ml某浓度的NaOH溶液,得到沉淀的质量是7.8g,则该NaOH溶液的物质的量浓度是
- A.1mol/L
- B.3mol/L
- C.5mol/L
- D.7mol/L
BD
分析:根据若碱不足,只发生Al3++3OH-═Al(OH)3↓来计算,若碱与铝离子的物质的量之比大于3:1,小于4:1,发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O来计算.
解答:沉淀的质量是7.8g,其物质的量为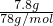 =0.1mol,
=0.1mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.1mol×3=0.3mol,
其物质的量浓度为 =3mol/L;
=3mol/L;
②碱与铝离子的物质的量之比大于3:1,小于4:1,
则由 Al3++3OH-═Al(OH)3↓
0.2mol 0.6mol 0.2mol
Al(OH)3+OH-═AlO2-+2H2O
(0.2-0.1)mol 0.1mol
则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,
其物质的量浓度为 =7mol/L;
=7mol/L;
故选BD.
点评:本题考查铝离子与碱的反应,明确碱的量的多少对反应的影响及发生的化学反应是解答本题的关键,难度不大.
分析:根据若碱不足,只发生Al3++3OH-═Al(OH)3↓来计算,若碱与铝离子的物质的量之比大于3:1,小于4:1,发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O来计算.
解答:沉淀的质量是7.8g,其物质的量为
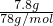 =0.1mol,
=0.1mol,①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.1mol×3=0.3mol,
其物质的量浓度为
 =3mol/L;
=3mol/L;②碱与铝离子的物质的量之比大于3:1,小于4:1,
则由 Al3++3OH-═Al(OH)3↓
0.2mol 0.6mol 0.2mol
Al(OH)3+OH-═AlO2-+2H2O
(0.2-0.1)mol 0.1mol
则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,
其物质的量浓度为
 =7mol/L;
=7mol/L;故选BD.
点评:本题考查铝离子与碱的反应,明确碱的量的多少对反应的影响及发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知2Fe2++Br2═2Fe3++2Br-,若向100mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,测得形成的溶液中Cl-和Br-的物质的量浓度相等,则FeBr2溶液的物质的量浓度为( )
| A、0.75mol?L-1 | B、1.5mol?L-1 | C、2mol?L-1 | D、0.3mol?L-1 |
将2.4g镁和铝合金投入100ml 2mol/L的硫酸中,充分反应后,再向其中加入2mol/L的NaOH溶液,当生成沉淀质量最大时,消耗NaOH溶液的体积是( )
| A、100ml | B、150ml | C、200ml | D、240ml |
 如图是某校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此下列说法正确的是( )
如图是某校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此下列说法正确的是( )