题目内容
下列反应中,与乙醛生成乙酸属于同一种反应类型的是 ( )。
A.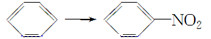
B.CH2=CHCl―→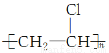
C.CH3CH2OH―→CH3CHO
D.CH3COOH―→CH3COOCH2CH3
C
【解析】乙醛生成乙酸属于氧化反应。A项属于取代反应;B项属于加聚反应;C项属于氧化反应;D项为酯化反应,属于取代反应。

练习册系列答案
相关题目
题目内容
下列反应中,与乙醛生成乙酸属于同一种反应类型的是 ( )。
A.
B.CH2=CHCl―→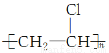
C.CH3CH2OH―→CH3CHO
D.CH3COOH―→CH3COOCH2CH3
C
【解析】乙醛生成乙酸属于氧化反应。A项属于取代反应;B项属于加聚反应;C项属于氧化反应;D项为酯化反应,属于取代反应。
