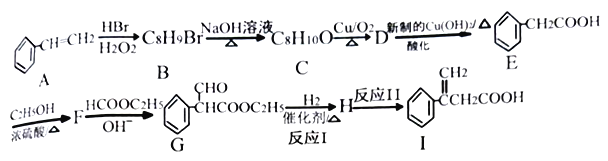
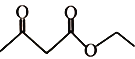
题目内容
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的某试剂充分反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶解,再加入适量的氢氧化镁,充分反应,过滤结晶即可;③为了除上硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为_____________(填化学式)而除去。
(2)①中加入的试剂应该选择_____为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式:______________________________。
(4)下列与方案③相关的叙述中,正确的是__________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.在pH<4 的溶液中Fe3+一定不能大量存在
C.调节溶液pH=4 可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4 的溶液中
【答案】 Fe(OH)3 NH3·H2O 2Fe3++3Mg(OH)2==2Fe(OH)3+3Mg2+ ACD
【解析】试题分析:在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的氨水,充分反应,过滤除去氢氧化铁,滤液结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶解,再加入适量的氢氧化镁,充分反应,过滤除去氢氧化铁、结晶即可;③为了除上硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤除去氢氧化铁、结晶即可。
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为Fe(OH)3而除去。
(2)为了防止引入杂质,①中加入的试剂应该选择NH3·H2O为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2==2Fe(OH)3+3Mg2+ 。
(4)与方案③相关的叙述中,A.H2O2是绿色氧化剂,其还原产物为水,在氧化过程中不引进杂质、不产生污染,A正确;B.在pH<4的溶液中Fe3+有可能大量存在,因为氢氧化铁可溶于酸,依据题意,在pH![]() 4的溶液中,Fe3+不能大量存在,B不正确;C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜,这样可以防止引入杂质,C正确;D.依据题意知,Cu2+可以大量存在于pH=4的溶液中,D正确。综上所述,正确的是ACD。
4的溶液中,Fe3+不能大量存在,B不正确;C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜,这样可以防止引入杂质,C正确;D.依据题意知,Cu2+可以大量存在于pH=4的溶液中,D正确。综上所述,正确的是ACD。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案