题目内容
5.一定温度下,有三种酸:A.盐酸,B.硫酸,C.醋酸,回答下列问题:①三种酸溶液等物质的量浓度时,c(H+)最大的是B;
②三种酸的c(H+)相同时,溶液浓度最大的是C;
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,再加入同样的锌粒,反应最快的是C.
分析 ①硫酸为二元强酸,盐酸为一元强酸,强酸完全电离,醋酸为一元弱酸,不完全电离;
②设三种酸的c(H+)为1mol/L,硫酸为二元强酸,则硫酸溶液的浓度为0.5mol/L,盐酸为一元强酸,则盐酸的浓度为1mol/L,醋酸为一元弱酸,不完全电离,则醋酸溶液的浓度大于1mol/L;
③由于醋酸存在电离平衡,加水稀释促进电离,因此c(H+)相同的三种酸均加水稀释至原来的100倍后,醋酸溶液中c(H+)最大,加入同样的锌粒,反应最快.
解答 解:①硫酸为二元强酸,盐酸为一元强酸,强酸完全电离,醋酸为一元弱酸,不完全电离,当三种酸溶液等物质的量浓度时,硫酸溶液中c(H+)是盐酸中c(H+)的2倍,醋酸溶液中c(H+)小于盐酸中c(H+),因此c(H+)最大的是硫酸,
故答案为:B;
②设三种酸的c(H+)为1mol/L,硫酸为二元强酸,则硫酸溶液的浓度为0.5mol/L,盐酸为一元强酸,则盐酸的浓度为1mol/L,醋酸为一元弱酸,不完全电离,则醋酸溶液的浓度大于1mol/L,因此溶液浓度最大的是醋酸溶液,
故答案为:C;
③由于醋酸存在电离平衡,加水稀释促进电离,因此c(H+)相同的三种酸均加水稀释至原来的100倍后,醋酸溶液中c(H+)最大,当加入同样的锌粒时,化学反应速率最快,
故答案为:C.
点评 本题考查了弱电解质的电离和化学反应速率影响因素,明确强电解质和弱电解质电离特点是解题的关键,难度不大,注意基础知识的积累.

练习册系列答案
 能力评价系列答案
能力评价系列答案
相关题目
15.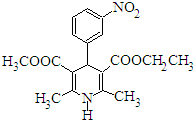 尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
 尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )| A. | 该物质的分子式为C18H20N2O6 | |
| B. | 该物质可以和银氨溶液发生银镜反应 | |
| C. | 该物质属于芳香族化合物,能溶于水 | |
| D. | 该物质在酸性条件下不发生水解反应 |
16. “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(1)═C2H4(g)+3O2(g).△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为C2H4(g)+H2O(1)═C2H5OH(1)△H=-44.2kJ/mol.
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
根据上表中数据分析:
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率:增大(填“增大”“减小”“不变”).
②该反应的正反应为放热(填“吸”或“放”)热反应.
(3)一定条件下,将3molH2和lmolCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g). 2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是cd.
a.该条件下此反应的化学平衡常数表达式为k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{{c}^{3}({H}_{2})•c(C{O}_{2})}$
b.H2的平均反应速率为0.3mol/(L•s)
c.CO2的转化率为60%
d.混合气体的密度不再改变时,该反应一定达到平衡状态
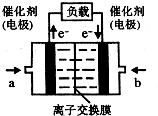
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是乙醇(填“乙醇”或“氧气”),b处电极上发生的电极反应是:O2+2H2O+4e-=4OH-.
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于5.6×10-5mo1/L.
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(1)═C2H4(g)+3O2(g).△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为C2H4(g)+H2O(1)═C2H5OH(1)△H=-44.2kJ/mol.
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率:增大(填“增大”“减小”“不变”).
②该反应的正反应为放热(填“吸”或“放”)热反应.
(3)一定条件下,将3molH2和lmolCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g). 2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是cd.
a.该条件下此反应的化学平衡常数表达式为k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{{c}^{3}({H}_{2})•c(C{O}_{2})}$
b.H2的平均反应速率为0.3mol/(L•s)
c.CO2的转化率为60%
d.混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是乙醇(填“乙醇”或“氧气”),b处电极上发生的电极反应是:O2+2H2O+4e-=4OH-.
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于5.6×10-5mo1/L.
 (写结构简式)
(写结构简式)
 治疗胃酸过多
治疗胃酸过多