题目内容
5.分析下列反应:3S+6KOH═2K2S+K2SO3+3H2O,据此作答:(1)用双线桥标出该反应中电子的转移方向和数目:3S+6KOH═2K2S+K2SO3+3H2O
(2)该反应的氧化产物是K2SO3.
(3)该反应的氧化剂与还原剂的质量比是2:1.
(4)当消耗0.3mol S时,则转移的电子数是0.44NA.
分析 (1)在3S+6KOH═2K2S+K2SO3+3H2O中,只有硫元素的化合价发生了变化,部分S由0价降为-2价,部分S由0价升为+4价,结合电子守恒可通过双线桥分析此氧化还原反应;
(2)氧化产物是元素化合价升高被氧化的产物;
(3)反应中硫元素的化合既升高又降低,硫既是氧化产物又是还原产物;
(4)若参加反应的硫是3mol时,只要搞清被氧化与被还原的硫的物质的量就可计算出转移电子数.
解答 解:(1)在3S+6KOH═2K2S+K2SO3+3H2O中,硫元素的化合价既升高又降低,其中有2个硫得4个电子化合价降为-2价,还原产物K2S,1个硫失4个电子,被氧化为K2SO3,可通过双线桥分析此反应: ,
,
故答案为: ;
;
(2)K2SO3是硫失去电子被氧化得到的产物,
故答案为:K2SO3;
(3)硫的化合价既升高又降低,硫既是氧化产物又是还原产物,其中有2个硫是得电子是氧化剂,1个硫是失电子是还原剂,可知氧化剂与还原剂的物质的量之比为2:1,质量比2:1,
故答案为:2:1;
(4)若0.3mol硫完全反应,0.1molS为还原剂,则反应中共转移电子0.1mol×(4-0)=0.4mol=0.4NA,
故答案为:0.4NA.
点评 本题考查了氧化还原反应的计算,题目难度中等,涉及氧化还原反应的配平、计算等知识,明确氧化还原反应的实质为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列事实不能用勒夏特列原理解释的是( )
| A. | 溴水中:Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 反应:CO+NO2?CO2+NO(△H<0),达平衡后,提高温度体系颜色变深 | |
| C. | 对于反应:2HI(g)?H2(g)+I2(g)达平衡后,缩小体积可使体系颜色变深 | |
| D. | 合成氨反应,为提高氨的产率,采取高压的措施 |
20.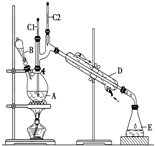 丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如图:
丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如图:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如表:
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移到B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,否(填“能”或“否”)将Na2Cr2O7溶液加到浓硫酸中.
(2)正丁醇在Cu/Ag,O2、加热条件下也可氧化为丁醛,反应的化学方程式为2CH3CH2CH2CHO+O2$→_{△}^{Cu/Ag}$2CH3CH2CH2CHO+2H2O.
(3)上述装置图中,D仪器的名称是冷凝管.加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(4)分液漏斗使用前必须进行的操作是C(填正确答案标号).
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)本实验中,正丁醛的产率为51%.(相对原子质量:C 12 H 1 O 16)
 丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如图:
丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如图:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如表:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移到B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,否(填“能”或“否”)将Na2Cr2O7溶液加到浓硫酸中.
(2)正丁醇在Cu/Ag,O2、加热条件下也可氧化为丁醛,反应的化学方程式为2CH3CH2CH2CHO+O2$→_{△}^{Cu/Ag}$2CH3CH2CH2CHO+2H2O.
(3)上述装置图中,D仪器的名称是冷凝管.加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(4)分液漏斗使用前必须进行的操作是C(填正确答案标号).
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)本实验中,正丁醛的产率为51%.(相对原子质量:C 12 H 1 O 16)
17.下列描述正确的是( )
| A. | 炭在常温下化学性质不活泼,因此在埋木桩前,可将埋入地下的一段表面用火微微烧焦 | |
| B. | 可用NaOH溶液除去MgCl2溶液中少量的FeCl3 | |
| C. | 足量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++2H2O+NO↑ | |
| D. | 向某溶液滴加盐酸酸化的氯化钡溶液,出现白色沉淀,则证明该溶液中含有SO42- |
14.下列说法不正确的是( )
| A. | 油脂属于酯类 | B. | 蛋白质水解的最终产物是氨基酸 | ||
| C. | 淀粉完全水解的产物是葡萄糖 | D. | 纤维素不能发生水解反应 |
15.下列说法中正确的是( )
| A. | 凡是吸热的都是非自发的 | B. | 自发反应熵一定增大 | ||
| C. | 自发反应在恰当条件下才能实现 | D. | 自发反应在任何条件下都能实现 |
