题目内容
【题目】由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下:
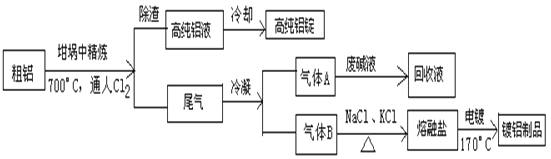
(注:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①________和②________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(3)在用废碱液处理气体A的过程中,所发生反应的离子方程式为________。
(4)镀铝电解池中,金属铝为________极,熔融盐电镀液中铝元素和氯元素主要以AlCl和Al2Cl形式存在,铝电极的主要电极反应式为___________________________。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是___________________。
【答案】(1)①2Al+Fe2O3Al2O3+2Fe;②4Al+3SiO22Al2O3+3Si;(2)HCl和AlCl3;NaCl;(3)Cl2+2OH-===Cl-+ClO-+H2O 、H++OH-===H2O;(4)阳,Al+4Cl--3e-===AlCl4-2Al+7Cl--6e-===Al2Cl7-;(5)氧化膜能隔绝空气,阻碍钢材被腐蚀。
【解析】试题分析:(1)①Al的金属性强于铁,和氧化铁发生铝热反应,2Al+Fe2O3![]() Al2O3+2Fe,石英砂的成分是SiO2,能与Al发生置换反应,因此反应是4Al+3SiO2
Al2O3+2Fe,石英砂的成分是SiO2,能与Al发生置换反应,因此反应是4Al+3SiO2![]() 2Al2O3+3Si;(2)粗铝中含有一定量的金属钠和氢气,H2+Cl2=2HCl,2Na+Cl2=2NaCl,2Al+3Cl2=2AlCl3,AlCl3易升华,因此除氯气外还含有HCl和AlCl3(g);NaCl熔点是801℃,而此时的温度是700℃,滤渣中为NaCl;(3)根据(2)的分析,以及流程,则气体A为Cl2和HCl,H+OH-=H2O,Cl2+2OH-=Cl-+ClO-+H2O;(4)既然是镀铝,所以铝必须作阳极,由于熔融盐中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,所以阳极的电极反应式为Al+4Cl--3e-===AlCl4-,2Al+7Cl--6e-===Al2Cl7-;(5)铝在空气中易形成一层致密而坚固的氧化膜,它能阻止内部的金属继续被氧化,起到防腐蚀保护作用。
2Al2O3+3Si;(2)粗铝中含有一定量的金属钠和氢气,H2+Cl2=2HCl,2Na+Cl2=2NaCl,2Al+3Cl2=2AlCl3,AlCl3易升华,因此除氯气外还含有HCl和AlCl3(g);NaCl熔点是801℃,而此时的温度是700℃,滤渣中为NaCl;(3)根据(2)的分析,以及流程,则气体A为Cl2和HCl,H+OH-=H2O,Cl2+2OH-=Cl-+ClO-+H2O;(4)既然是镀铝,所以铝必须作阳极,由于熔融盐中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,所以阳极的电极反应式为Al+4Cl--3e-===AlCl4-,2Al+7Cl--6e-===Al2Cl7-;(5)铝在空气中易形成一层致密而坚固的氧化膜,它能阻止内部的金属继续被氧化,起到防腐蚀保护作用。