题目内容
【题目】(1)硼酸(H3BO3)是一种白色固体,可溶于水,其水溶液为一元弱酸。硼酸分子中硼原子的杂化类型为______________;写出硼酸在水溶液中电离方程式 +H2O
+H2O![]() _______。
_______。
(2)CS2、NO2+具有相同的通式AX2,它们的价电子总数都是16。 CO32-、NO3-等微粒具有相同的通式:_______,它们的价电子总数是______________,因此它们与由第VIA族两元素组成的___________________(填分子式)分子结构相同,呈______形。
(3)一个尿素[CO(NH2)2]分子中含有______个![]() 键;1 mol化合物Fe(CO)5分子中所含
键;1 mol化合物Fe(CO)5分子中所含![]() 键数目为_________。
键数目为_________。
【答案】 sp2 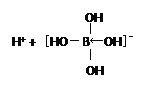 (或H+ + H4BO4-) AX3 24 SO3 平面三角形 7 10NA
(或H+ + H4BO4-) AX3 24 SO3 平面三角形 7 10NA
【解析】试题分析:(1)B原子最外层有3个电子,以3个共价键与3个羟基结合;硼酸本身不能电离出氢离子,而硼酸与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-),因而溶液呈酸性;(2)CO32-、NO3-等微粒中心原子与氧原子的个数比是1:3;价电子总数是各原子最外层电子数与离子所带电荷的差。VIA族两元素组成的原子的个数比是1:3的化合物是SO3;SO3的价电子对数为3,无孤对电子,根据价电子理论分析空间构型;(3)根据分子结构分析σ键数。
解析:(1)B原子最外层有3个电子,以3个共价键与3个羟基结合,B原子价电子对数为3,所以硼酸分子中硼原子的杂化类型为sp2;硼酸本身不能电离出氢离子,而硼酸与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-),硼酸在水溶液中电离方程式 +H2O
+H2O![]()
 ;
;
(2)CO32-、NO3-等微粒中心原子与氧原子的个数比是1:3,通式是AX3;价电子总数是各原子最外层电子数与所带电荷的差,CO32-、NO3-的价电子总数是24。VIA族两元素组成的原子的个数比是1:3的化合物是SO3;SO3中S原子的价电子对数为3,无孤对电子,空间构型是平面三角形;(3)CO(NH2)2分子中有2个C-N、4个N-H和1个C=O,所以CO(NH2)2分子有7个σ键;Fe(CO)5分子中有5个C![]() O,5个Fe、C结合的配位键,所以1 mol化合物Fe(CO)5分子中所含
O,5个Fe、C结合的配位键,所以1 mol化合物Fe(CO)5分子中所含![]() 键数目为10NA。
键数目为10NA。


