题目内容
【题目】ClO2与Cl2的氧化性相近,常温下均为气体,在自来水消毒和果蔬保鲜等方面应用广泛某兴趣小组通过图1装置(夹持装置略)对其制备吸收释放和应用进行了研究


(1)仪器B的名称是:____,请在方框中画出F中缺少的部分____。

(2)打开B的活塞,A中氯酸钠和稀盐酸混和产生Cl2和ClO2,写出反应化学方程式:_______________________; 调节分液漏斗B的旋塞,减缓稀盐酸滴加速度的作用是________
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成1.81g NaClO2,此时F中溶液的颜色不变,则装置C中装的药品的作用是:__________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为:_____________________________________________________________________。
(5)在ClO2释放实验中,打开E的活塞,D中发生反应,理论上产生ClO2 在标准状况下的体积为_____________ (保留两位小数); 此时装置F的作用是:______________
(6)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图2所示,若将其用于水果保鲜,你认为效果较好的稳定剂是____,(选填“I”或“II”)
理由是:_________________________________________________________________
【答案】 分液漏斗 ![]() 2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O 为使ClO2在D中被稳定剂充分吸收 吸收Cl2 4H++5ClO2=Cl+4ClO2↑+2H2O 0.36L 检验是否有ClO2生成(只要能表述出检验ClO2即可) II 稳定剂 II可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O 为使ClO2在D中被稳定剂充分吸收 吸收Cl2 4H++5ClO2=Cl+4ClO2↑+2H2O 0.36L 检验是否有ClO2生成(只要能表述出检验ClO2即可) II 稳定剂 II可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度
【解析】(1)结合仪器结构可知仪器B的名称是分液漏斗,F中淀粉—KI溶液是检验ClO2气体的,导管应长进短出,具体装置连接方式为![]() ;
;
(2)A中氯酸钠和稀盐酸混和产生Cl2和ClO2,发生反应化学方程式为A中发生:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O;为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;
(5)1.81g NaClO2的物质的量为![]() =0.02mol,生成ClO2 的物质的量为0.02mol×
=0.02mol,生成ClO2 的物质的量为0.02mol×![]() =0.16mol,体积为0.16mol×22.4L/mol=3.6L; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
=0.16mol,体积为0.16mol×22.4L/mol=3.6L; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
(6)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好。

【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂。
Ⅰ.实验室制取CH3Cl的原理是CH3OH +HCl(浓)![]() CH3Cl+H2O。具体步骤如下:
CH3Cl+H2O。具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,
同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集。
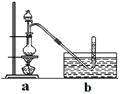
请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是 。
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是 。
(3)实验室为何用排水法收集CH3Cl? 。
Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化。现有四只洗气瓶;分别盛有以下试剂:
A.1.5%KMnO4(H+)溶液; | B.蒸馏水; | C.5%Na2SO3溶液; | D.98%H2SO4。 |
(1)为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶 (填洗气瓶编号),如果观察到 则证实上述资料的正确性。
(2)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):
(3)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛 的洗气瓶。
