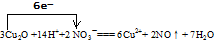题目内容
将下列四种物质:NO、Cu(NO3)2、Cu2O、HNO3的化学式分别填在空白处,并组成一个配平了的化学方程式:(已知氧化性:HNO3>Cu(NO3)2)______+______→______+______+H2O
(1)该反应中的还原剂是______.
(2)该反应中,发生还原反应的元素是______.
解:NO中N元素化合价为+2,HNO3中N元素化合价为+5,Cu(NO3)2中Cu元素化合价为+2,Cu2O中Cu元素化合价为+1,且
氧化性:HNO3>Cu(NO3)2,所以硝酸作氧化剂得电子生成NO,则Cu2O失电子化合价升高作还原剂,生成Cu(NO3)2,
所以该反应方程式为:3Cu2O+14HNO3═6Cu(NO3)2+2NO↑+7H2O,
故答案为:3Cu2O、14HNO3、6Cu(NO3)2、2NO↑;
(1)该反应中氧化亚铜失电子化合价升高,所以氧化亚铜作还原剂,故答案为:Cu2O;
(2)该反应的硝酸中N元素得电子化合价降低,所以N元素发生还原反应,故答案为:N.
分析:氧化还原反应中,化合价升高的物质作还原剂,化合价降低的物质作氧化剂,且氧化性:HNO3>Cu(NO3)2,所以硝酸作氧化剂,氧化亚铜中铜元素的化合价小于硝酸铜中铜元素的化合价,所以氧化亚铜作还原剂,硝酸铜作氧化产物,一氧化氮作还原产物,失电子化合价升高的物质作还原剂,得电子的元素发生还原反应.
点评:本题考查了氧化还原反应,明确元素的化合价是解本题的关键,难度不大.
氧化性:HNO3>Cu(NO3)2,所以硝酸作氧化剂得电子生成NO,则Cu2O失电子化合价升高作还原剂,生成Cu(NO3)2,
所以该反应方程式为:3Cu2O+14HNO3═6Cu(NO3)2+2NO↑+7H2O,
故答案为:3Cu2O、14HNO3、6Cu(NO3)2、2NO↑;
(1)该反应中氧化亚铜失电子化合价升高,所以氧化亚铜作还原剂,故答案为:Cu2O;
(2)该反应的硝酸中N元素得电子化合价降低,所以N元素发生还原反应,故答案为:N.
分析:氧化还原反应中,化合价升高的物质作还原剂,化合价降低的物质作氧化剂,且氧化性:HNO3>Cu(NO3)2,所以硝酸作氧化剂,氧化亚铜中铜元素的化合价小于硝酸铜中铜元素的化合价,所以氧化亚铜作还原剂,硝酸铜作氧化产物,一氧化氮作还原产物,失电子化合价升高的物质作还原剂,得电子的元素发生还原反应.
点评:本题考查了氧化还原反应,明确元素的化合价是解本题的关键,难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目