题目内容
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
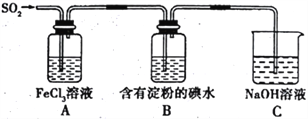
A. 为了验证A 中发生了氧化还原反应,加入稀盐酸酸化的BaCl2溶液,产生白色沉淀
B. 该实验装置至少存在一处设计缺陷
C. 向反应后的A 溶液中加入酸性KMnO4溶液,紫红色褪去,说明一定有Fe2+
D. 装置B是为了验证还原性: SO2>I-
【答案】C
【解析】A、Fe3+具有强氧化性,与SO2发生2Fe3++2H2O+SO2=2Fe2++SO42-+4H+,加入稀盐酸酸化的BaCl2,发生Ba2++SO42-=BaSO4↓,从而说明A中发生氧化还原反应,故A说法正确;B、缺少防倒吸装置,故B说法正确;C、A装置中含有过量的SO2,SO2能使酸性高锰酸钾溶液褪色,对Fe2+检验产生干扰,故C说法错误;D、淀粉褪色,说明发生SO2+I2+2H2O=H2SO4+2HI,根据还原剂的还原性强于还原产物的还原性,即还原性:SO2>I-,故D说法正确。

练习册系列答案
相关题目


