题目内容
【题目】(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___(填字母代号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。

a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ),是铜的一种重要化合物。其中En 是乙二胺(H2N-CH2-CH2-NH2)的简写。
①该配合物中含有化学键有___(填字母编号)。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为___、___。
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___。
④乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___,其中与乙二胺形成的化合物稳定性相对较高的是___(填“Mg2+”或“Cu2+”)。
⑤与氨气互为等电子体的阳离子为___,与S位于同一周期,且第一电离能小于S的非金属元素符号为___。
(5)①金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为____。

A. B.
B.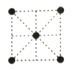 C.
C. D.
D.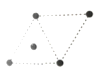
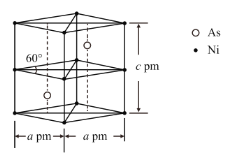
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=__g·cm-3。
【答案】X-射线衍射 A<C<B<D c、d ABCD sp3 sp3 乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+ H3O+ Si D ![]()
【解析】
(1).晶体对X-射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2).轨道中电子能量:1s<2s<2p,能量较高的轨道中电子越多,该微粒能量越高;
(3).a.Cl-Cl键的键能为119.6kJmol-1×2;
b.Na的第一电离能为495.0kJmol-1;
c.NaCl的晶格能为785.6kJmol-1;
d.Cl的第一电子亲和能为348.3kJmol-1;
(4).①配合物内部配体存在共价键,配体和中心离子之间存在配位键,内界和外界存在离子键;
②配体乙二胺分子中C和N均达到饱和,均为sp3杂化;
③乙二胺和甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,考虑分子间形成氢键造成沸点升高;
④含有孤电子对的原子和含有空轨道的原子之间易形成配位键;碱土金属与乙二胺形成的化合物稳定性较弱;
⑤NH3中含有10个电子,由4个原子构成,与氨气互为等电子体的阳离子有H3O+,同一周期元素从左到右,元素的第一电离能呈增大趋势,但第ⅡA族、第VA族元素的第一电离能大于相邻元素;
(5).①由图可知,金属钛的原子按ABABABAB……方式堆积,属于六方最密堆积,晶胞结构为 ,故金属钛晶胞俯视图为D;
,故金属钛晶胞俯视图为D;
②该晶胞中As原子个数是2、Ni原子个数=4×![]() +4×
+4×![]() +2×
+2×![]() +2×
+2×![]() =2,其体积=(a×10-10cm×a×10-10cm×
=2,其体积=(a×10-10cm×a×10-10cm×![]() )×c×10-10 cm=
)×c×10-10 cm=![]() a2c×10-30 cm3,晶胞密度=
a2c×10-30 cm3,晶胞密度= g/cm3。
g/cm3。
(1)从外观无法区分三者,但用X光照射挥发现:晶体对X-射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定,
故答案为:X-射线衍射;
(2)轨道中电子能量:1s<2s<2p,能量较高的轨道中电子越多,该微粒能量越高,所以2p轨道上电子越多、1s轨道上电子越少,该微粒能量越高,根据图知能量由低到高的顺序是A<C<B<D,
故答案为:A<C<B<D;
(3)a.ClCl键的键能为119.6kJmol1×2=239.2kJ/mol,故a错误;
b.Na的第一电离能为495.0kJmol1,故b错误;
c.NaCl的晶格能为785.6kJmol1,故c正确;
d.Cl的第一电子亲和能为348.3kJmol1,故d正确;
故答案选cd;
(4)①配合物内部配体存在共价键,配体和中心离子之间存在配位键,内界和外界存在离子键,乙二胺中存在极性共价键和非极性共价键,
故答案为:A、B、C、D;
②配体乙二胺分子中C形成4个σ键,且无孤对电子,N形成3个σ键,有一对孤对电子,均为sp3杂化,
故答案为:sp3;sp3;
③乙二胺和甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,考虑分子间形成氢键造成沸点升高,可以解释为乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键,
故答案为:乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
④由于乙二胺的两个N可提供孤对电子给金属离子形成配位键,因此乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子;由于铜离子的半径较大且含有的空轨道多于镁离子,因此与乙二胺形成的化合物稳定性相对较高的是Cu2+,
故答案为:乙二胺的两个N提供孤对电子给金属离子形成配位键;Cu2+;
⑤NH3中含有10个电子,由4个原子构成,与氨气互为等电子体的阳离子有H3O+;同一周期元素从左到右,元素的第一电离能呈增大趋势,但第ⅡA族、第/span>VA族元素的第一电离能大于相邻元素,故与S位于同一周期,且第一电离能小于S的非金属元素为Si;
故答案为:H3O+;Si;
(5)①由图可知,金属钛的原子按ABABABAB……方式堆积,属于六方最密堆积,晶胞结构为 ,故金属钛晶胞俯视图为D。
,故金属钛晶胞俯视图为D。
故答案选D;
②该晶胞中As原子个数是2、Ni原子个数=4×![]() +4×
+4×![]() +2×
+2×![]() +2×
+2×![]() =2,其体积=(a×10-10cm×a×10-10cm×
=2,其体积=(a×10-10cm×a×10-10cm×![]() )×c×10-10 cm=
)×c×10-10 cm=![]() a2c×10-30 cm3,晶胞密度=
a2c×10-30 cm3,晶胞密度= g/cm3=
g/cm3=![]() g/cm3,
g/cm3,
故答案为:![]() 。
。

【题目】X、Y是同周期的两种主族元素,他们的逐级电离能(I)数据如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 | …… |
X | 496 | 4562 | 6912 | 9543 | 13353 | …… |
Y | 738 | 1451 | 7733 | 10540 | 13630 | …… |
下到有关说法正确的是( )
A.电负性:X<YB.与水反应剧烈程度:X<Y
C.X的最外层电子数为1D.Y的最高化合价为+3






