题目内容
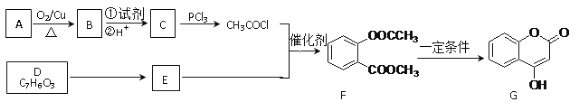
【题目】下图是合成聚碳酸酯的过程(PC)(反应条件和部分产物未写出):

信息提示:苯酚分子中与酚羟基直接相连的碳原子的邻、对位上的氢原子有很好的反应活性,易跟某些含羰基的化合物![]() (R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水。苯酚还能发生如下反应生成有机酸酯:
(R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水。苯酚还能发生如下反应生成有机酸酯:

请写出:
(1)X的结构简式____________。
(2)在一定条件下X与COClCl反应合成聚碳酸酯的化学方程式_________。
(3)X和浓溴水反应时,1 mol X最多能消耗Br2________mol。
(4)与乙酸苯酚酯分子式相同,分子中含有苯环且属于酯的其他可能有机物的结构简式_____________________。
【答案】 
 4
4 ![]()
![]() 、
、
【解析】(1) 由
由![]() 和
和 缩聚而得,故X的结构简式为
缩聚而得,故X的结构简式为 。
。
(2)在一定条件下 与COClCl反应合成聚碳酸酯的化学方程式:
与COClCl反应合成聚碳酸酯的化学方程式: ;
;
(3) 属于酚类,与溴水反应,溴取代在羟基的邻对位,由于对位已被占据,故只有邻位(4个),故1 mol X最多能消耗4mol Br2。
属于酚类,与溴水反应,溴取代在羟基的邻对位,由于对位已被占据,故只有邻位(4个),故1 mol X最多能消耗4mol Br2。
(4)与乙酸苯酚酯分子式相同,分子中含有苯环、酯基。若是一取代,可以组成酯基与亚甲基,酯基与甲基如![]() ;若二取代,可组成甲酸酯基、甲基,再考虑它们的位置关系,如:
;若二取代,可组成甲酸酯基、甲基,再考虑它们的位置关系,如:
![]() ,共五种。
,共五种。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ![]() ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而______(填“增大”或“减小”),其原因是_______。图中的压强由大到小的顺序为________,其判断理由是________。

(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为_______________________,正极的反应式为________________________。
【题目】在一定温度下,将H2和I2(g)各0.16mol充入10L恒容密闭容器中,发生反应H2(g)+I2(g)![]() 2HI(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下:
2HI(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下:
t/min | 2 | 4 | 7 | 9 |
N(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A. 反应前4min的平均速率v(HI)=2.5×10-3mol/(Lmin)
B. 当体系压强不再改变时可以判断反应达到平衡状态
C. 该温度下此反应的书衡常数K=1.44
D. 再充入0.05molH2、0 .05molI2(g)和0.06molHI,平衡不移动