题目内容
一定条件下反应:2A(g)+B(g) 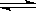 3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
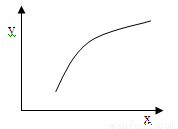
选项 | x | y |
A | A的浓度 | 平衡常数K |
B | 温度 | 混合气体的密度 |
C | B的物质的量 | A的转化率 |
D | 催化剂的质量 | C的体积分数 |
已知某化学反应的平衡常数表达式为K=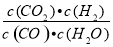 ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A.该反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D.若平衡浓度符合下列关系式: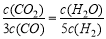 ,则此时的温度为1000℃
,则此时的温度为1000℃
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
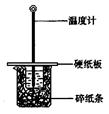
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会 __ __
(5)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.已知:
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、5mol/L硝酸钠溶液、0.5mol/L硝酸钠溶液、0.1mol/L稀盐酸、蒸馏水.
方案测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(2)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
③解释乙同学的实验现象在此酸性条件下NO3-不能氧化Cu.
(3)请你设计更简便可行的实验方案,帮助甲同学达到实验目的将铜片放入0.5mol/L氯化铁溶液中.
Ⅱ.聚合氯化铁铝(简称PAFC),其化学通式为[FexAly(OH)aClb•zH2O]m.某同学为测定其组成,进行如下实验:①准确称取4.505 0g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.330 0g固体.②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+.用0.100 0mol•L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00mL.③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.305 0g白色沉淀.(相对原子质量或式量:Fe-56 Al-27 Cl-35.5 O-16 H-1 Fe2O3-160 Al2O3-102 AgCl-143.5 H2O-18)
(4)若滴定管在使用前未用KMnO4标准溶液润洗,测得的Al3+含量将偏低(填“偏高”“偏低”或“不变”).
(5)通过计算确定PAFC的化学式[FeAl3(OH)9Cl3•3H2O]m或FeAl3(OH)9Cl3•3H2O(写出计算过程;不要求写出反应方程式;m为聚合度,不必求出).
| A. | 一定有甲烷 | B. | 一定有乙烷 | C. | 一定无甲烷 | D. | 可能有乙烯 |


 C2H4(g)①
C2H4(g)① 2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时 SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9, b、c表示),
b、c表示), 1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量 燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1
燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1