题目内容
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
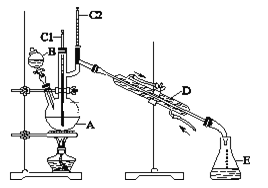
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量3.2g。
回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为__________________________。
(2)若加热后发现未加沸石,应采取的正确方法是___________________________。
(3)上述装置图中,E仪器的名称是________________________。 B使用前必须进行的操作是_____________。
(4)检验粗产品中的正丁醛的方法________________________________________。(用适当的文字和反应方程式表达)
(5)反应温度应保持在90~95 ℃,其原因是__________________________________
(6)本实验中,正丁醛的产率为_______________ %(结果保留两位小数)。
【答案】往Na2Cr2O7溶液中滴加浓硫酸 冷却后补加沸石。 锥形瓶 检漏。 取少量粗品溶液于试管,加入氢氧化钠碱化后,加入新制的斐林试剂,加热,出现砖红色说明产生了正丁醛,CH3CH2CH2CHO+2Cu(OH)2+NaOH=CH3CH2CH2COONa+Cu2O↓+3H2O 保证正丁醛及时蒸出,尽量避免正丁醛被进一步氧化 82.22
【解析】
(1)根据浓硫酸稀释回答;
(2)加入沸石的作用是防止暴沸,加热后发现未加沸石,应冷却后补加;
(3)根据装置图分析仪器名称;分液漏斗使用前要验漏;
(4)醛基能与斐林试剂反应生成砖红色沉淀;
(5)根据正丁醛的沸点和化学性质回答;
(6)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O列方程计算;
(1)浓硫酸密度大,与Na2Cr2O7溶液混合放出大量的热,易发生危险,所以Na2Cr2O7溶液和浓硫酸添加的顺序为往Na2Cr2O7溶液中滴加浓硫酸;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却至室温后补加;
(3)根据装置图,可知E仪器的名称是锥形瓶;B是分液漏斗,分液漏斗使用前要检查其是否漏液,影响实验操作;
(4)取少量粗品溶液于试管,加入氢氧化钠碱化后,加入新制的斐林试剂,加热,出现砖红色说明产生了正丁醛,反应方程式是CH3CH2CH2CHO+2Cu(OH)2+NaOH=CH3CH2CH2COONa+Cu2O↓+3H2O;
(5)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90—95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(6)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,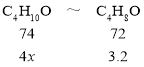 x=0.8222;本实验中,正丁醛的产率为82.22 %。
x=0.8222;本实验中,正丁醛的产率为82.22 %。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
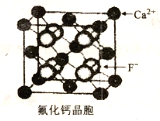
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。