题目内容
9.下列说法不正确的是( )| A. | 在熔融状态下,1molNa2O2完全电离出的离子数目为3NA(NA代表阿伏加德罗常数的值) | |
| B. | 酸性氧化物不一定是非金属氧化物,碱性氧化则一定是金属氧化物 | |
| C. | 常温下醋酸分子不可能存在于pH>7的碱性溶液中 | |
| D. | 第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
分析 A、过氧化钠是由钠离子和过氧根离子构成;
B、和碱反应生成盐和水的氧化物为酸性氧化物,和酸反应生成盐和水的氧化物为碱性氧化物;
C、醋酸钠溶液水解生成醋酸和氢氧化钠显碱性;
D、同主族非金属氢化物稳定性减弱,第ⅥA中氧元素形成的氢化物分子间存在氢键,熔沸点反常的高.
解答 解:A、过氧化钠是由钠离子和过氧根离子构成,在熔融状态下,1molNa2O2完全电离出的离子数目为3NA,故A正确;
B、和碱反应生成盐和水的氧化物为酸性氧化物,可以是金属氧化物如Mn2O7,和酸反应生成盐和水的氧化物为碱性氧化物,一定是金属氧化物,故B正确;
C、醋酸钠溶液水解生成醋酸和氢氧化钠显碱性,醋酸和醋酸钠按照不同比例混合可以显碱性,常温下醋酸分子可能存在于pH>7的碱性溶液中,故C错误;
D、同主族非金属氢化物稳定性减弱,第ⅥA中氧元素形成的氢化物分子间存在氢键,熔沸点反常的高,故D正确;
故选C.
点评 本题考查了物质分类的方法和物质结构分析,概念的实质理解是解题关键,注意氢化物稳定性和熔沸点的分析判断,题目难度中等.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
20.向铜粉和铁粉中加入过量热的浓硝酸,充分反应后,溶液中大量共存的金属阳离子是( )
| A. | Fe2+ | B. | Fe3+ | C. | Fe3+、Cu2+ | D. | Fe2+ Cu2+ |
17.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: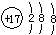 | |
| B. | 作为相对原子质量测定标准的碳核素:12C | |
| C. | 氨气(NH3)中氮元素的化合价是+3 | |
| D. | Na+的电子式:Na+ |
4.下列各物质中的少量杂质,可用括号内的试剂和方法除去的是( )
| A. | 乙醇中含有水(生石灰,蒸馏) | |
| B. | 甲烷中含有乙烯(溴水,洗气) | |
| C. | 溴苯中溶有溴(苯,分液) | |
| D. | 乙烷中含有乙烯(酸性高锰酸钾溶液,洗气) |
18.下列操作能导致置换反应发生的是( )
| A. | 将铜片置于盐酸中 | B. | 将锌片置于MgCl2溶液中 | ||
| C. | 将铁片置于CuSO4溶液中 | D. | Na2CO3 溶液与CaCl2溶液混合 |
19.主族元素X的阳离子和主族元素Y的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
| A. | X的原子半径比Y的大 | B. | X原子的最外层电子数比Y的大 | ||
| C. | X的原子序数比Y的小 | D. | X元素的最高正价比Y的大 |
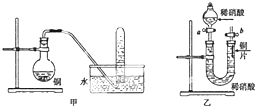 如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题:
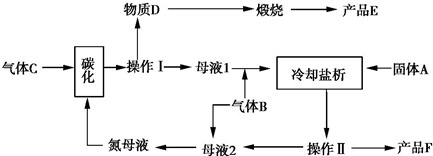
如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题: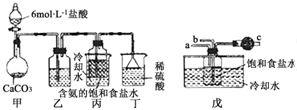 “侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下:
“侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下: