题目内容
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是
| A.自来水 | B.0.5 mol·L-1盐酸 |
| C.0.5 mol·L-1CH3COOH溶液 | D.0.5 mol·L-1KCl溶液 |
B
解析试题分析:溶液导电能力强弱与溶液中离子浓度大小和离子所带电荷数有关系,所以溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05 mol NaOH后,导电性突然增大;A正确;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强;C正确;0.5 mol·L-1的KCl中加入0.05 mol NaOH固体后,离子浓度增大,导电能力增强;D正确;只有0.5 mol·L-1的盐酸能与NaOH反应生成强电解质NaCl,溶液导电性变化不大,答案选B。
考点:考查溶液导电性强弱的有关判断

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
现有两瓶温度分别为15℃和45℃,pH均为l的硫酸溶液,下列有关说法不正确的是
| A.两溶液中的c(OH-)相等 | B.两溶液中的c(H+)相同 |
| C.等体积两种溶液中和碱的能力相同 | D.两溶液中的c(H2SO4)基本相同 |
下列各项所给的两个量,前者—定小于后者的是:
①纯水在25℃和80℃的pH; ②1moINaHSO4和1mo1 Na2SO4在熔化状态下的离子数;
③25℃时,等体积且pH都等于3的盐酸和AlCl3的溶液中,已电离的水分子数;
④常温下,pH为10的氨水溶液和pH为12氨水溶液中所含溶质分子数。
| A.①② | B.②④ | C.①③ | D.②③ |
在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的是
| A.Mg(OH)2的溶解度最小 | B.Ca(OH)2的溶解度最小 |
| C.AgCl的溶解度最小 | D.物质Ksp越大溶解度也越大 |
用食用白醋(醋酸浓度约1mol?L-1)进行下列实验,能证明醋酸为弱电解质的是
| A.白醋中滴入石蕊试液呈红色 |
| B.白醋能溶解氢氧化铜 |
| C.蛋壳浸泡在白醋中有气体放出 |
| D.pH试纸显示白醋的pH为2.3 |
室温下向10 mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目增加,导电性增强 |
| B.醋酸的电离程度增大,c(H+)亦增大 |
| C.再加入10 m L pH="11" NaOH溶液,混合液pH=7 |
D.溶液中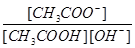 不变 不变 |
25 ℃时,浓度均为0.1 mol·L-1的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
| A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(B+) |
| B.若将0.1 mol·L-1 BOH溶液稀释至0.001 mol·L-1则溶液的pH=9 |
| C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) |
| D.若将上述两溶液按体积比1∶1混合,则混合液中:c(A-)>c(B+)>c(H+)>c(OH-) |
下列说法不正确的是( )
| A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |