题目内容
【题目】用“>”“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
(2)相同条件下,2 mol氢原子所具有的能量______1 mol氢分子所具有的能量。
(3)已知常温下红磷比白磷稳定,比较下列反应中(反应条件均为点燃)ΔH的大小:ΔH1______ ΔH2。
①P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1,
②4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2。
(4)已知:101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则碳的燃烧热数值________110.5 kJ·mol-1。
(5)已知:稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量________57.3 kJ;稀硫酸和稀氢氧化钡溶液中和生成1 mol 水放出的热量_______________57.3 kJ。
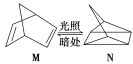
(6)已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
【答案】=><>>><
【解析】
(1)反应热与反应物的总能量和生成物的总能量有关,与反应条件无关。
(2)化学键断裂为吸热过程,新键生成放热的过程。
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多。
(4)燃烧热是指在101kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量。
(5)浓硫酸稀释放热;硫酸和氢氧化钡反应生成水和硫酸钡沉淀时,因为伴随着沉淀热,故放出的热量增大。
(6)合成氨反应是可逆反应,反应物不能完全消耗。
(1)同温同压下,氢气和氯气生成氯化氢气体的焓变与过程、反应条件无关,只与反应始态、终态有关,所以ΔH1=ΔH2;正确答案:=。
(2)2 mol氢原子合成1 mol氢分子时形成化学键,要放出热量,故前者能量大;正确答案:>。
(3)红磷比白磷稳定,红磷的能量比白磷低,红磷燃烧时放出的热量少,带负号比较时,后者大;正确答案:< 。
(4)CO燃烧时还能放出热量,所以碳的燃烧热值大于110.5 kJ·mol-1;正确答案:>。
(5)浓硫酸稀释时能放出热量,故与稀NaOH溶液反应生成1mol水,放出的热量大于57.3 kJ;稀硫酸和稀氢氧化钡溶液反应时生成硫酸钡,还需形成化学键(生成硫酸钡),放出能量,故中和时生成1mol水放出的热量大于57.3 kJ;正确答案: >;>。
(6)合成氨反应是可逆反应,1 mol N2和3 mol H2放在一密闭容器中不能全部反应,故放出的热量小于92.0 kJ;正确答案:<。

 名校课堂系列答案
名校课堂系列答案