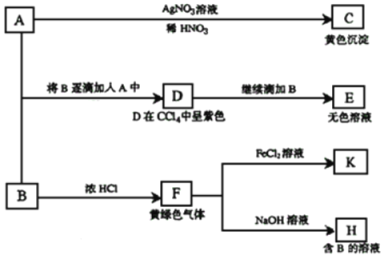
题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
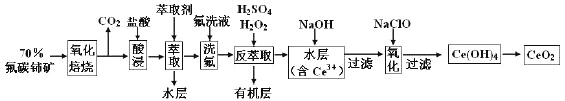
已知:①Ce4+既能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是__________________________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:_________________________________;为避免产生上述污染,请提出一种解决方案:________。
(3)“萃取”时存在反应:Ce4++n(HA)2 ![]() Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为___________; ____________________________________________________________。
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为___________; ____________________________________________________________。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+,H2O2在该反应中作_________(填“催化剂”、“氧化剂”或“还原剂”),每有1mol H2O2参加反应,转移电子的物质的量为________________。
(5)“氧化”步骤的化学方程式为________________________________。
(6)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗25.00mL标准溶液。该产品中CeO2的质量分数为________。
【答案】
(1)增大固体与气体的接触面积,增大反应速率;提高原料的利用率。
(2)2 CeO2 +2C1-+8H+=2Ce3++C12↑+4H2O;将HCl(盐酸)改用H2SO4酸浸
(3)分液漏斗
(4)还原剂;2mol
(5) 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl
(6) 95.56%。
【解析】
试题分析:(1)“氧化焙烧”前需将矿石粉碎成细颗粒,可以增大固体与气体的接触面积,增大反应速率;提高原料的利用率,故答案为:增大固体与气体的接触面积,增大反应速率;提高原料的利用率;
(2)“酸浸”中产生的黄绿色气体为氯气,是CeO2与盐酸发生氧化还原反应造成的,反应的离子方程式为2 CeO2 +2C1-+8H+=2Ce3++C12↑+4H2O,为避免产生上述污染可以选用H2SO4代替,故答案为:2 CeO2 +2C1-+8H+=2Ce3++C12↑+4H2O;将HCl(盐酸)改用H2SO4酸浸;
(3)实验室中萃取时用到的主要玻璃仪器有分液漏斗,故答案为:分液漏斗;
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+,转化过程中Ce的化合价降低被还原,H2O2在该反应中作还原剂,每有1mol H2O2参加反应,O的化合价有-1变成-2,转移电子的物质的量为2mol,故答案为:还原剂;2mol;
(5)“氧化”步骤中次氯酸钠将Ce3+氧化为Ce(OH)4,反应的化学方程式为2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl,故答案为:2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;
(6)用0.1000mol/LFeSO4溶液滴定至终点,铈被还原成Ce3+,则Fe2+被氧化为Fe3+,则
CeO2 ~ FeSO4
0.0025mol 0.1000mol/L-1×0.025L
所以m(CeO2)=0.0025mol×172g/mol=0.43g,产品中Ce(OH)4的质量分数为![]() ×100%=95.56%,故答案为:95.56%%。
×100%=95.56%,故答案为:95.56%%。