题目内容
根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO在碱性条件下将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率。
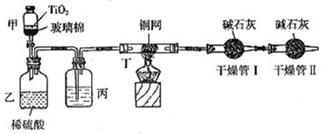
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出有关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅰ的作用是 ,干燥管Ⅱ的作用是
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比 (填:“偏高”或“偏低”),简述可能的原因:
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为 。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出有关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅰ的作用是 ,干燥管Ⅱ的作用是
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比 (填:“偏高”或“偏低”),简述可能的原因:
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为 。
(1)CN-+ClO-=CNO-+Cl―(2分)
2CNO-+6ClO―+8H+=N2↑+2CO2↑+3Cl2↑+4H2O (2分)
(2)浓硫酸, 除去Cl2,吸收CO2(都1分)
防止空气中的CO2、水蒸气进入,干扰实验(2分)
(3)偏低,(1分)装置中残留有CO2未被完全吸收(1分)
(4)80%(2分)
2CNO-+6ClO―+8H+=N2↑+2CO2↑+3Cl2↑+4H2O (2分)
(2)浓硫酸, 除去Cl2,吸收CO2(都1分)
防止空气中的CO2、水蒸气进入,干扰实验(2分)
(3)偏低,(1分)装置中残留有CO2未被完全吸收(1分)
(4)80%(2分)
(1)由题目所给信息知:甲装置中发生反应CN-+ClO-=CNO-+Cl―,乙装置中生成气体:2CNO-+6ClO―+8H+=N2↑+2CO2↑+3Cl2↑+4H2O;
(2)题目“是通过测定CO2的量来确定对CN-的处理效果”,结合所给仪器可知:丁装置是吸收除氯气,丙装置中的浓硫酸吸水干燥,干燥管Ⅰ用来吸收生成的CO2,而干燥管Ⅱ的作用是为了防止空气中的CO2、水蒸气进入,引起误差。
(3)由于装置中残留部分气体,导致干燥管Ⅰ吸收的CO2偏少,则由此计算出的“被处理CN-”的量偏少
(4)由CN-~CO2可计算出被氧化的CN-为0.032mol,其处理百分率为: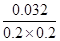 =0.8
=0.8
(2)题目“是通过测定CO2的量来确定对CN-的处理效果”,结合所给仪器可知:丁装置是吸收除氯气,丙装置中的浓硫酸吸水干燥,干燥管Ⅰ用来吸收生成的CO2,而干燥管Ⅱ的作用是为了防止空气中的CO2、水蒸气进入,引起误差。
(3)由于装置中残留部分气体,导致干燥管Ⅰ吸收的CO2偏少,则由此计算出的“被处理CN-”的量偏少
(4)由CN-~CO2可计算出被氧化的CN-为0.032mol,其处理百分率为:
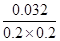 =0.8
=0.8
练习册系列答案
相关题目