题目内容
8.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是地壳中含量最多的元素.常温下,Y的块状单质在Z的最高价氧化物对应水化物的浓溶液中会发生钝化.下列说法正确的是( )| A. | X与W位于同一主族 | |
| B. | 原子半径:X>Y | |
| C. | 最简单氢化物的稳定性:X>Z | |
| D. | 最高价氧化物对应水化物的酸性:Z>W |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是地壳中含量最多的元素,则X为O元素;常温下,Y的块状单质在Z的最高价氧化物对应水化物的浓溶液中会发生钝化,则Y为Al、Z为S元素,故W为Cl,结合元素周期律解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是地壳中含量最多的元素,则X为O元素;常温下,Y的块状单质在Z的最高价氧化物对应水化物的浓溶液中会发生钝化,则Y为Al、Z为S元素,故W为Cl.
A.X为O元素、W为Cl元素,二者不是同主族元素,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:X(O)<Y(Al),故B错误;
C.非金属性X(O)>Z(S),故最简单氢化物的稳定性:X>Z,故C正确;
D.非金属性Cl>S,故Cl元素最高价氧化物对应水化物的酸性更强,故D错误,
故选C.
点评 本题考查元素周期律、结构位置性质关系,推断元素是解题关键,需要学生熟练掌握元素化合物性质,难度中等.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
3.下列有关说法正确的是( )
| A. | 陶瓷的主要成分是碳酸钙 | |
| B. | 用铁容器存放浓盐酸 | |
| C. | 硅是制造半导体的常用材料 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
13.1mol•L-1 MgCl2溶液的含义是( )
| A. | 1 L水中含有1 mol MgCl2 | |
| B. | Cl-浓度为2 mol•L-1 | |
| C. | 溶液中含有1 mol MgCl2 | |
| D. | 将95 g MgCl2溶于1 L水中所得的溶液 |
17.实验室蒸发NaCl溶液时,一般有以下操作过程:其正确的操作顺序为( )
①固定铁圈位置 ②加热蒸发,并不断搅拌③放置酒精灯④将蒸发皿放置在铁圈上⑤停止加热,利用余热蒸干.
①固定铁圈位置 ②加热蒸发,并不断搅拌③放置酒精灯④将蒸发皿放置在铁圈上⑤停止加热,利用余热蒸干.
| A. | ①②③④⑤ | B. | ②③④⑤① | C. | ③①④②⑤ | D. | ⑤④③②① |
18.下列叙述,正确的是( )
| A. | 电解质在电流的作用下发生电离 | |
| B. | 存在自由移动的离子是电解质溶液能导电的原因 | |
| C. | 金属铜能导电,所以铜是电解质 | |
| D. | 硫酸氢钠在水溶液中能电离出氢离子,所以硫酸氢钠属于酸 |
 研究化学反应的快慢和限度具有十分重要的意义,请回答下列问题:
研究化学反应的快慢和限度具有十分重要的意义,请回答下列问题: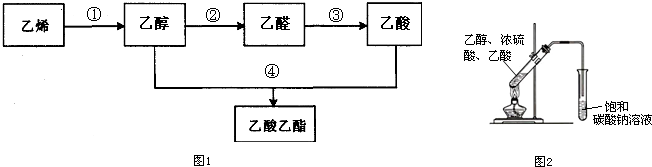
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.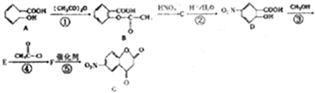
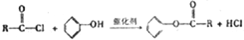
 .写出F与过量NaOH共热时反应的化学方程式
.写出F与过量NaOH共热时反应的化学方程式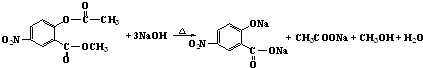 .
. 或
或 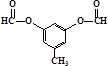 .
. 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.