题目内容
已知:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;D的基态原子的M电子层上有4个未成对电子。
请回答下列问题:
(1)D是元素周期表中第________周期,第________族的元素;其基态原子的外围电子排布式为________。
(2)A、B、C、D四种元素中,电负性最大的是________(填元素符号)。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为________。B的氢化物的沸点远高于A的氢化物的沸点的主要原因是________________________________________________________________。
(4)D能与AC分子形成D(AC)5,其原因是AC分子中含有________________。D(AC)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断D(AC)5晶体属于________(填晶体类型)。
(5)SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞。再在每两个相邻的Si原子(距离最近的两个Si原子)中心连线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有________个Si原子,________个O原子。
(1)四 Ⅷ 3d64s2 (2)O (3)sp NH3分子间能形成氢键
(4)孤电子对 分子晶体
(5)8 16
【解析】本题以原子结构的特点为元素推断的核心,综合考查了电负性、等电子体、配合物理论以及晶体结构等。由A的基态原子有3个不同的能级,各能级中电子数相等,可知A的基态原子电子排布式为1s22s22p2,为碳元素;由C的基态原子2p能级上的未成对电子数与A原子相同,为2个,故其基态原子电子排布式为1s22s22p4,为氧元素,依据A、B、C的原子序数逐渐增大可知B为氮元素;由D的基态原子的M电子层上有4个未成对电子,可知其基态原子电子排布式为[Ar]3d64s2,为铁元素。
(3)OCN-的中心原子C原子的孤电子对数为0,故采取sp杂化。氨气的沸点远高于甲烷的沸点是因为前者形成氢键。
(5)一个氯化钠晶胞中含4个钠离子及4个氯离子,含有8个“小立方体”,每个不共面的“小立方体”中心处放置一个Si原子,故一个SiO2的晶胞中含有8个Si原子,而硅原子和氧原子个数比为1∶2,故含16个O原子。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如下表:
元素 | 相关信息 |
Q | Q的单质是实验室常用的惰性电极材料 |
R | R原子基态时2p原子轨道上有3个未成对电子 |
T | 负二价的元素T的氢化物在通常状况下是一种液体,且其中T的质量分数为88.9% |
X | X是第三周期电负性最大的元素 |
Y | 元素Y位于周期表的第10列 |
Z | Z存在质量数为65,中子数为36的核素 |
(1)Z元素的原子基态时的电子排布式是________。
(2)下列叙述正确的是________(填字母序号)。
a.Q的气态氢化物比R的气态氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素的氢化物中最低
d.R的第一电离能、电负性都比Q的大
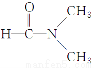
(3)Q和T可形成两种常见化合物,分别表示为QT和QT2。QT分子中σ键和π键的个数比为________;QT2分子中,Q原子采取________杂化。
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2分子具有相似的结构。故R2T的空间构型是________,其为________(填“极性”或“非极性”)分子。
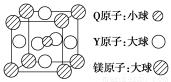
(5)含有Q、Y和镁三种元素的某种晶体具有超导性,其结构如图所示。则该晶体的化学式为________;晶体中每个镁原子周围距离相等且最近的Y原子有______个。