题目内容
19.下列说法正确的是( )| A. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 原子晶体中只存在非极性共价键 | |
| C. | 氨、水是极性分子 | |
| D. | 金属元素和非金属元素形成的化合物一定是离子化合物 |
分析 A.稳定性是化学性质与氢键无关;
B.原子晶体二氧化硅中硅氧极性共价键;
C.极性分子中正负电荷的中心不重合,具有一定的极性;
D.金属元素和非金属元素形成的化合物大部是离子化合物,极少部分是共价化合物.
解答 解:A.H2O是一种非常稳定的化合物,与H-O键有关,而与氢键无关,故A错误;
B.原子晶体二氧化硅中硅氧极性共价键,所以不一定只存在非极性共价键,故B错误;
C.氨气结构不对称,正负电荷的中心不重合,属于极性分子,故C正确;
D.金属元素和非金属元素形成的化合物大部是离子化合物,极少部分是共价化合物,如氯化铝,故D错误;
故选C.
点评 本题考查氢键与化学键、氢键与物质的性质和分子的极性,明确氢键只影响物质的物理性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
7.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 标准状况下,22.4L CHCl3含有的分子数为NA | |
| B. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 0.1mol/L的NH4NO3溶液中含有的氮原子数为0.2NA |
11.下列各组离子能在pH=1的无色溶液中大量共存的是( )
| A. | Mg2+、Cl-、Na+、SO42- | B. | Ba2+、Na+、NO3-、MnO4- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Ca2+、Na+、Fe3+、CO32 |
8.某溶液中存在大量的H+、Cl-、SO42-,该溶液中还可能大量存在的是( )
| A. | CO32- | B. | Ba2+ | C. | Ag+ | D. | Al3+ |
9.下列实验所采取的方法正确的是( )
| A. | 除去苯中苯酚,加入溴水后过滤 | |
| B. | 乙醛中含乙酸杂质,加入氢氧化钠溶液洗涤,分液 | |
| C. | 除去乙酸乙酯中乙酸,加入饱和NaOH溶液,振荡静置后分液 | |
| D. | 区别乙酸、乙醛、乙醇,加入新制的Cu(OH)2悬浊液加热 |

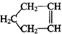 可简写为
可简写为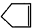 ,
,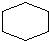 C6H12
C6H12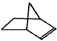 C7H10.
C7H10.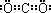 .
.