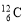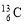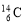题目内容
工业上通过电解饱和的食盐水来制取氯气。现取100mL含NaCl为11.7g的饱和食盐水进行电解,
(1)写出电解饱和食盐水制取氯气的化学方程式
(2)在标准状况下制得Cl2多少升?
(3)所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
(1) 2NaCl + 2H2O = 2NaOH + Cl2↑+ H2↑ 2分
(2)2.24L (3分) (3)2 mol/L (3分)
【解析】
试题分析:n(NaCl)=11.7÷58.5=0.2mol
2NaCl + 2H2O = 2NaOH + Cl2↑+ H2↑
0.2mol 0.2mol 0.01mol
标准状况下制得Cl2体积为2.24L;所得NaOH的物质的量浓度c= 0.2mol÷0.1L=2 mol/L
考点:考查根据化学方程式计算有关问题。

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目