题目内容
11.下列叙述正确的是( )| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性 | |
| C. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 | |
| D. | Li、Na、K的原子半径和密度随原子序数的增加而增大 |
分析 A、根据氯气具有强氧化性,和铁反应产生氯化铁,而稀盐酸和铁反应产生氯化亚铁分析;
B、根据硫酸钾为强酸强碱盐,而硫酸锌为强酸弱碱盐分析;
C、根据非金属性越强,最高价氧化物对应的水化物的酸性越强分析;
D、根据电子层数越多,原子半径越大分析.
解答 解:A、氯气具有强氧化性,和铁反应产生氯化铁,而稀盐酸和铁反应产生氯化亚铁,故A错误;
B、硫酸钾为强酸强碱盐,而硫酸锌为强酸弱碱盐,因此钾和锌反应产生的氯硫酸钾、硫酸锌分别显中性和酸性,故B错误;
C、C、P、S、Cl的非金属性增强,因此最高价氧化物对应的水化物的酸性也逐渐增强,故C正确;
D、电子层数越多,原子半径越大,Li、Na、K的电子层数逐渐增大,因此半径是增大的,但是密度逐渐减小,故D错误;
故选C.
点评 本题考查了元素周期表的运用,明确规律并熟练其意义是解题的关键,另外熟练掌握氯气的强氧化性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.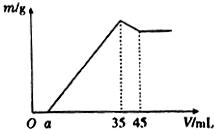 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )| A. | 3.50mol/L | B. | 1.75mol/L | C. | 0.85mol/L | D. | 无法计算 |
2.200mL 0.3mol•L-1的K2SO4溶液和100mL 0.2mol•L-1的Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO${\;}_{4}^{2-}$的物质的量浓度为( )
| A. | 0.3 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.45 mol•L-1 | D. | 0.5 mol•L-1 |
6.下列事实可证明氨水是弱碱的是( )
| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氨水可以使酚酞试液变红 | |
| D. | 常温下,0.1 mol/L氨水的pH约为9 |
16.镁铝合金质优体轻,又不易锈蚀,被大量用于航空工业、造船工业、日用化工等领域.下列关于镁铝合金性质的叙述中,正确的是( )
| A. | 此合金的熔点比镁和铝的熔点都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 此合金的硬度比镁和铝的硬度都小 |
3.下列说法正确的是( )
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| C. | 化合物  在酸性条件下水解,所得溶液加碱加热后有NH3生成 在酸性条件下水解,所得溶液加碱加热后有NH3生成 | |
| D. | 桶烯(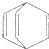 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 |
1.下列说法错误的是( )
| A. | 丁达尔效应可以区分溶液和胶体 | |
| B. | 向硫酸亚铁的溶液中滴加氢氧化钠溶液,最终可以得到白色沉淀 | |
| C. | 用容量瓶配置溶液的实验中,定容时俯视刻度会导致所配溶液浓度偏高 | |
| D. | 工业上用电解熔融Al2O3的方法得到单质Al |