题目内容
2.在一定温度下,均能形成单键的A2、B2、AB三种分子有如下反应发生:A2(g)+B2(g)?2AB(g),该反应达到平衡时的标志是( )| A. | A2的生成速率与AB的分解速率相等 | |
| B. | 单位时间内生成 2nmolAB,同时生成 nmolA2 | |
| C. | 单位时间内1molA-A键断裂,同时断裂2molA-B | |
| D. | A2、B2、AB的浓度不再变化,且A2、B2、AB的分子数之比为1:1:2 |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:A.A2的生成速率是逆反应速率,AB的分解也是逆反应,故A2的生成速率与AB的分解速率相等不能作为判断是否达到化学平衡状态的依据,故A错误;
B.单位时间内生成2nmolAB是正反应,同时生成nmolA2是逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,故B正确;
C.单位时间内1molA-A键断裂是正反应,同时断裂2molA-B键是逆反应,故单位时间内1molA-A键断裂,同时断裂2molA-B键能作为判断是否达到化学平衡状态的依据,故C正确;
D.平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故A2、B2、AB的分子数之比1:1:2不能作为判断是否达到平衡状态的依据,故D错误,
故选BC.
点评 本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征,正逆反应速率相同,各种物质的浓度不再变化.

练习册系列答案
相关题目
12.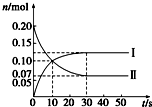 (1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.
①图象中曲线I (选填“Ⅰ”或“Ⅱ”)表示NO2的变化.
②若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是放热反应.
③在800℃时,若缩小容器的体积,达新平衡时n(NO)< (选填“>”、“=”或“<”)0.07mol,NO的转化率增大 (选填“增大”、“不变”或“减小”)
(2)一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ•mol-1
①下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号)
a.v消耗(SiF4)=4v生成(HF) b.容器内气体压强不再变化
c.容器内气体的总质量不再变化 d.HF的体积分数不再变化
②反应过程中测定的部分数据如下表(表中t2>t1)所示.
通过a或b的值及化学平衡原理判断t1时反应是否达到化学平衡状态t1时反应已经达到化学平衡状态.
 (1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.①图象中曲线I (选填“Ⅰ”或“Ⅱ”)表示NO2的变化.
②若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是放热反应.
③在800℃时,若缩小容器的体积,达新平衡时n(NO)< (选填“>”、“=”或“<”)0.07mol,NO的转化率增大 (选填“增大”、“不变”或“减小”)
(2)一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ•mol-1
①下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号)
a.v消耗(SiF4)=4v生成(HF) b.容器内气体压强不再变化
c.容器内气体的总质量不再变化 d.HF的体积分数不再变化
②反应过程中测定的部分数据如下表(表中t2>t1)所示.
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
13. 如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )
如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )
①取上层液体放在另一试管Q中,向Q中加水,若不分层则上层是水
②向试管中加溴水,振荡静置后呈仍为无色的是水层
③直接向试管中加水,振荡,高度增加的液体层是水层
④向试管中加酒精,高度增加的液体层是有机层.
 如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )
如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )①取上层液体放在另一试管Q中,向Q中加水,若不分层则上层是水
②向试管中加溴水,振荡静置后呈仍为无色的是水层
③直接向试管中加水,振荡,高度增加的液体层是水层
④向试管中加酒精,高度增加的液体层是有机层.
| A. | ①③ | B. | ①②③ | C. | ②④ | D. | ①②③④ |
10.硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq)下列说法一定正确的是( )
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
| A. | 硼酸滴入碳酸氢钠溶液中有CO2产生 | |
| B. | 醋酸滴入碳酸氢钠溶液中有CO2产生 | |
| C. | 相同温度,等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 | |
| D. | 相同温度,pH相等的碳酸溶液与醋酸溶液,它们的物质的量浓度也相等 |
7.下列反应中,属于加成反应的是( )
| A. | 乙烯使溴水褪色 | |
| B. | 乙烯使酸性高锰酸钾溶液褪色 | |
| C. | 乙烯在空气中燃烧 | |
| D. | 还原性铁粉做催化剂用苯与液溴制溴苯 |
11.下列各组中的两种物质,能用淀粉碘化钾试纸检验的是( )
| A. | 溴水和碘水 | B. | 盐酸和稀硫酸 | C. | 溴水和稀HCl | D. | 浓HNO3和氯水 |
12.化学与生活密切相关,下列不正确的是( )
| A. | 聚乙烯是无毒高分子,用作食品包装袋 | |
| B. | 石油的干馏得到汽油、柴油、煤油 | |
| C. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| D. | 王水是由浓盐酸和浓硝酸按3:1混合 |