题目内容
 CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命.一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇一氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法中错误的是( )
CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命.一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇一氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法中错误的是( )| A、负极的电极反应式为CO+O2--2e-=CO2 | B、工作时电极b作正极,O2一由电极a向电极b移动 | C、工作时电子由电极a通过传感器流向电极b | D、传感器中通过的电流越大,尾气中CO的含量越高 |
分析:该装置属于原电池,一氧化碳失电子发生氧化反应生成二氧化碳,则通入一氧化碳的电极为负极,正极上氧气得电子发生还原反应,原电池放电时电子从负极流向正极,阴离子向负极移动,一氧化碳的含量越大,原电池放电时产生的电流越大.
解答:解:A.负极上一氧化碳失电子和氧离子反应生成二氧化碳,电极反应式为CO+O2--2e-=CO2,故A正确;
B.原电池放电时,阴离子向负极移动,该原电池中,a是负极,b是正极,所以氧离子由b电极向a电极移动,故B错误;
C.放电时,a作负极,b作正极,电子从负极a通过传感器流向电极b,故C正确;
D.一氧化碳的含量越大,一氧化碳失电子越多,则原电池放电时产生的电流越大,故D正确;
故选B.
B.原电池放电时,阴离子向负极移动,该原电池中,a是负极,b是正极,所以氧离子由b电极向a电极移动,故B错误;
C.放电时,a作负极,b作正极,电子从负极a通过传感器流向电极b,故C正确;
D.一氧化碳的含量越大,一氧化碳失电子越多,则原电池放电时产生的电流越大,故D正确;
故选B.
点评:本题是对CO-O2型燃料电池原理的考查,根据原电池正负极上得失电子及反应类型、离子的移动方向等来分析解答,注意电解质特点,难度不大.

练习册系列答案
相关题目
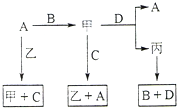 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:
