��Ŀ����
����Ŀ����ͼ��ʾΪ��ˮ�ۺ����õIJ������̣������й�˵����ȷ����
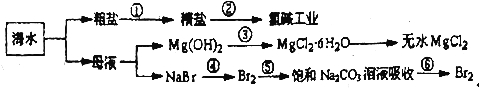
A. �ڢٲ��г�ȥ�����е�SO42����Ca2+��Mg2+��Fe3+�����ʼ����ҩƷ˳��ΪNaOH��Һ��Na2CO3��Һ��BaCl2��Һ�����˺������
B. �ڢڲ���һ��������ת��Ϊ��ѧ�ܵĹ��̣���ҵ�Ͽɲ���ʯīΪ�缫�����������ӽ���Ĥ�ĵ��װ��
C. �ڢ۲��нᾧ����MgC12��6H2O���ڿ��������ȷֽ�����ˮMgC12
D. �ڢܲ��з�Ӧ�����ӷ���ʽΪC12+2Br��=2C1��+Br2���ڢܢݲ���Ŀ���Ǹ�����Ԫ��
���𰸡�D
��������
��ˮͨ������Ũ���õ����κ�ĸҺ�����ξ��Ƴ�ȥ���ʵõ����Σ���ⱥ��ʳ��ˮ�õ��������ơ�������������ĸҺ�к���þ���Ӻ������ӣ�����ʯ�������þ���ӹ��˵õ�������þ��������Һ��������þ�ܽ��Ũ����������ȴ�ᾧ������ϴ�ӣ����Ȼ��������м���ʧȥ�ᾧˮ�õ���ˮ�Ȼ�þ����Һ�м�����������ˮ����������Ϊ�嵥�ʣ����崵����̼������Һ���պ��������������嵥�ʣ��Դ˽����⡣
A��ѡ���е��Լ�����˳���У��������������ȥ��������ҩƷ˳��Ϊ��BaCl2��Һ��NaOH��Һ��Na2CO3��Һ�����˺�����ᣬ��A����B���ڢڲ��ǵ��ʳ��ˮ���ǽ�����ת��Ϊ��ѧ�ܵĹ��̣���ҵ�Ͽɲ�������Ϊʯī�����ӽ���ĤΪ�����ӽ���Ĥ�ĵ��װ�ã���B����C���ɢ۵�ת����֪���ᾧˮ����ʧȥ�ᾧˮ�������Ȼ�þ��Ϊ��ֹþ����ˮ�⣬Ӧ���Ȼ��������н��У���C����D���ڢܲ�����Ԫ�ر�������������Ӧ�����ӷ���ʽΪC12+2Br��=2C1��+Br2���ڢܲ�������������Ϊ�嵥�ʣ��ڢݲ����嵥����̼������Һ�з����绯��Ӧ�����廯�ƺ������ƣ��ڢ����廯�ƺ������ƾ��ữת��Ϊ�嵥�ʣ������Тܢݲ�Ŀ����Ũ���������嵥�ʣ���D��ȷ���ʴ�ΪD��

 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
