题目内容
北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
__________KIO3+__________KI+__________H2SO4=__________K2SO4+__________I2+__________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是__________;
②b中反应所产生的I2的物质的量是__________mol。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
__________KIO3+__________KI+__________H2SO4=__________K2SO4+__________I2+__________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是__________;
②b中反应所产生的I2的物质的量是__________mol。
(1)1 ,5,3,3,3,3
(2)① SO32-+I2+H2O=2I-+SO42-+2H+
②在B后增加;充分振荡分液漏斗并静置一段时间
(3)①溶液由蓝色变无色,半分钟不变色 ②1.0×10-5 mol
(2)① SO32-+I2+H2O=2I-+SO42-+2H+
②在B后增加;充分振荡分液漏斗并静置一段时间
(3)①溶液由蓝色变无色,半分钟不变色 ②1.0×10-5 mol
KIO3中I由+5→0,得5e-,KI中I由-1→0,失1e-,得失电子相等。(2)①KI的化学计量数应为5,KIO3为1,生成I2为3,H2SO4和H2O都是3。I2氧化Na2SO3离子反应为SO32-+I2+2H2O=2I-+SO42-+2H+,②萃取时应充分振荡,静置。(3)①I2完全反应时,淀粉指示剂不显颜色,且半分钟仍为无色。②因I2—2S2O32-消耗Na2S2O3为n(Na2S2O3)=2.0×10-3mol·L-1×0.010 L=2×10-5 mol,n(I2)= =1×10-5。
=1×10-5。
 =1×10-5。
=1×10-5。
练习册系列答案
相关题目
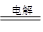 2Cu+O2↑+4H+
2Cu+O2↑+4H+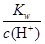 =0.1 mol·L-1的溶液:Na+、Cu2+、HCO3-、NO3-
=0.1 mol·L-1的溶液:Na+、Cu2+、HCO3-、NO3-