题目内容
(15分)
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________.
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
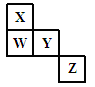
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。

(5)该晶胞的边长为a×10 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为
__________cm。
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________.
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。

(5)该晶胞的边长为a×10
 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为__________cm。
(1)锰(1分) 3d54s1(2分)
(2)HF分子间存在氢键,而HCl分子间无氢键(2分)
(3)O>Cl(1分) 正四面体形(1分) sp3杂化(1分)
(4)Na2O(2分) 8(1分) 离子晶体(1分)
(5) ×10-10或
×10-10或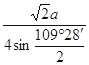 ×10-10或
×10-10或 ×10-10(3分,或其他合理答案)
×10-10(3分,或其他合理答案)
(2)HF分子间存在氢键,而HCl分子间无氢键(2分)
(3)O>Cl(1分) 正四面体形(1分) sp3杂化(1分)
(4)Na2O(2分) 8(1分) 离子晶体(1分)
(5)
 ×10-10或
×10-10或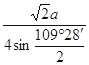 ×10-10或
×10-10或 ×10-10(3分,或其他合理答案)
×10-10(3分,或其他合理答案)试题分析:依题意可知:M为氧元素,N为钠元素,O是氯元素,P是铬元素,Q是锰元素,因此有:
(1)元素Q的名称为锰,P的基态原子价层电子排布式为3d54s1;
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低是因为HF分子间存在氢键,而HCl分子间无氢键
(3)M、O电负性大小顺序是O>Cl,O的最高价含氧酸根为ClO4-,空间构型为正四面体。空间构型其中心原子的杂化类型为sp3杂化
(4)M微粒的数目为:
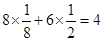 ;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。
;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。(5)
 ×10-10或
×10-10或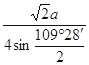 ×10-10或
×10-10或 ×10-10
×10-10
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目