题目内容
分别位于元素周期表的第2、3周期的主族元素A和B,它们的离子的电子层相差2层.已知A处于第m族,B处于第n族,A只有正化合价.则A、B原子核外电子总数分别为
- A.m、n
- B.3、7
- C.m-2、10n
- D.m+2、n+10
D
解析:
A元素只有正化合价,所以A为金属元素,形成阳离子时一般失去一个电子层;
由于A、B分别位于第2、3周期,且离子的电子层相差2层,所以A位于第2周期第m族,B位于第3周期第n族且为非金属元素,所以,A、B分别有2个、3个电子层.在主族元素中,其最外层电子数与族序数相等,因而,A、B的核外电子总数分别为2+m、10+n.
解析:
A元素只有正化合价,所以A为金属元素,形成阳离子时一般失去一个电子层;
由于A、B分别位于第2、3周期,且离子的电子层相差2层,所以A位于第2周期第m族,B位于第3周期第n族且为非金属元素,所以,A、B分别有2个、3个电子层.在主族元素中,其最外层电子数与族序数相等,因而,A、B的核外电子总数分别为2+m、10+n.

练习册系列答案
相关题目
 现有四种元素,分别位于元素周期表的前四个不同周期,其原子序数总和为48.由它们可组成甲、乙、丙、丁四种单质和A、B、C、D四种化合物,其中甲、乙为非金属单质,丙、丁为金属单质.这些物质间的转化关系如图所示(反应条件已省略)
现有四种元素,分别位于元素周期表的前四个不同周期,其原子序数总和为48.由它们可组成甲、乙、丙、丁四种单质和A、B、C、D四种化合物,其中甲、乙为非金属单质,丙、丁为金属单质.这些物质间的转化关系如图所示(反应条件已省略)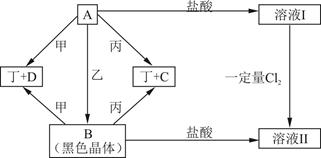
 B的化学方程式___________________________________.
B的化学方程式___________________________________.