题目内容
3.下列各种比较中,正确的是( )| A. | 元素电负性:P>F | B. | 第一电离能(I1):P(磷)>Se(硒) | ||
| C. | 离子半径:Cl-<K+ | D. | 熔沸点:MgCl2<AlCl3 |
分析 A.根据同周期元素从左到右电负性逐渐增大,同主族元素电负性从上到下逐渐减小判断;
B.P原子核外最外层电子为半充满状态,难以失去电子;
C.具有相同的核外电子排布的离子,核电荷数越大离子半径越小;
D.AlCl3为共价化合物,熔沸点较低.
解答 解:A.同周期元素从左到右电负性逐渐增大,则有F>N,同主族元素电负性从上到下逐渐减小,则N>P,所以电负性F>P,故A错误;
B.P原子核外最外层电子为半充满状态,难以失去电子,故B正确;
C.具有相同的核外电子排布的离子,核电荷数越大离子半径越小,应为Cl->K+,故C错误;
D.AlCl3为共价化合物,对应的晶体为分子晶体,而氯化镁为离子晶体,故D错误.
故选B.
点评 本题考查元素周期律知识,题目难度不大,本题注意把握元素周期律的递变规律即可解答,注意氯化铝为共价化合物,沸点较低.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
8.亚运期间,一些易燃、易爆、剧毒品、易腐蚀品等,严禁旅客带上车.下列化学药品,不允许旅客带上车的有
①浓硫酸②氰化钾③水银④TNT炸药⑤汽油⑥白磷( )
①浓硫酸②氰化钾③水银④TNT炸药⑤汽油⑥白磷( )
| A. | 只有①②④⑤⑥ | B. | 只有①②③④ | C. | 只有①②④ | D. | 都不行 |
14.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
①反应速率最大的(即0min~1min、1min~2min、2min~3min、3min~4min、4min~5min)时间段为2 min~3 min,原因是因该反应是放热反应,此时温度高.
②反应速率最小的时间段为4 min~5 min,原因是此时H+浓度小.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入以下物质以减缓反应速率
A.蒸馏水 B.更加细小的锌粒 C.NaCl溶液
你认为他的做法可行的是AC(填相应字母)
| 时间 (min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
②反应速率最小的时间段为4 min~5 min,原因是此时H+浓度小.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入以下物质以减缓反应速率
A.蒸馏水 B.更加细小的锌粒 C.NaCl溶液
你认为他的做法可行的是AC(填相应字母)
8.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为10,则X在第3周期第ⅡA族 |
15.下列各组中两个化学反应,属于同一反应类型的一组是( )
| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 由苯制溴苯;由乙烷与氯气在光照下的反应 |
12.以下叙述中,错误的是( )
| A. | 非金属元素只能形成共价化合物 | |
| B. | 在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 离子化合物可能含有共价键原子核之间的排斥作用 |
13.下列说法不正确的是( )
| A. | 使用可再生能源,用超临界二氧化碳替代有机溶剂,注重原子经济性,采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 13C与14C属于同一种元素,它们互为同位素 | |
| C. | 通过化学变化可以实现235U与238U的相互转化 | |
| D. | 同位素示踪法是研究化学反应历程的手段之一 |
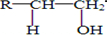 $→_{△}^{浓硫酸}$R-CH=CH2+H2O)
$→_{△}^{浓硫酸}$R-CH=CH2+H2O)
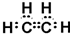 .
.